内部機能系理学療法診断学演習 代謝パート副資料
(選 木村朗)
導入
PPT1>DM11
引用(https://www.nutri.co.jp/nutrition/keywords/ch5-3/keyword1/)
糖尿病リスク予測ツール
2018年12月19日掲載2019年11月13日改定版掲載
3年後に2型糖尿病になるリスクを予測するツール(30~64歳まで)を、国立国際医療研究センター 臨床研究センター 疫学・予防研究部のグループが開発しました。
糖尿病リスク予測ツール
https://www.ncgm.go.jp/riskscore/
もあわせてご覧ください。
糖尿病がある方の人数は日本のみならず世界的に増えており、国や世界の機関はその対策に尽力しています。
糖尿病がある方がどれだけいてどのような状態にあるか、治療にかかる費用はどれくらいかなどを把握することは、糖尿病の対策を立て、その効果を評価するために重要なことです。
ここでは、糖尿病に関する制度・統計や社会的な課題について理解し、理学療法士として取り組むべきことが説明できるようになりましょう。
糖尿病とは
2022年4月14日掲載改訂:2016年6月3日, 2019年10月30日,2021年9月15日
初版:2015年10月27日
糖尿病は、インスリンが十分に働かないために、血液中を流れるブドウ糖という糖(血糖)が増えてしまう病気です。インスリンは膵臓から出るホルモンであり、血糖を一定の範囲におさめる働きを担っています。
血糖の濃度(血糖値)が何年間も高いままで放置されると、血管が傷つき、将来的に心臓病や、失明、腎不全、足の切断といった、より重い病気(糖尿病の慢性合併症)につながります。また、著しく高い血糖は、それだけで昏睡(こんすい)などをおこすことがあります(糖尿病の急性合併症)。
ここでは糖尿病についての基本的なお話をします。
目次
血糖とインスリンについて
私たちが食事をすると、栄養素の一部は糖となって腸から吸収されます。寝ている間など、食事をしない時間が続くときには、主に肝臓により糖が作られています。糖はからだにとって大切であり、食事をしたときも、食べていないときも、常に血液中を流れています。糖は血液の流れに乗って、からだのあらゆる臓器や組織へめぐります。
血液中をただよい、筋肉などの細胞までたどり着いた糖は、同じく血液中に流れていたインスリンの助けを借りて細胞に取り込まれます。取り込まれた糖は、私たちのからだが活動するためのエネルギーの源となります。
インスリンは細胞のドアを開ける鍵のような役割を果たしています(図1:糖とインスリンの働き)。インスリンの働きによって、細胞の前まで到着した糖はすみやかに細胞の中に入り、糖は血液中にあふれることなく、血液中の糖の濃度は一定の範囲におさまっています。
図1:糖とインスリンの働き

- 糖はからだのエネルギー源です
- 糖をエネルギーとして使うにはインスリン(鍵)が必要となります
「インスリンが十分に働かない」ってどういうこと?
糖尿病になるとインスリンが十分に働かず、血糖をうまく細胞に取り込めなくなるため、血液中に糖があふれてしまいます。これには、2つの原因があります(図2:インスリンが十分に働かない)。
- インスリン分泌低下:膵臓の機能の低下により、十分なインスリンを作れなくなってしまう状態。細胞のドアを開けるための鍵が不足しているので、糖が中に入れず、血液中にあふれてしまいます。
- インスリン抵抗性:インスリンは十分な量が作られているけれども、効果を発揮できない状態。運動不足や食べ過ぎが原因で肥満になると、インスリンが働きにくくなります。鍵であるインスリンがたくさんあっても、細胞のドアのたてつけが悪く、開けることができません。この場合も、血液中に糖があふれてしまいます。
糖尿病ではこの2つが影響して、血糖値が高くなってしまいます。
図2:インスリンが十分に働かない

1.インスリン分泌低下
インスリン(鍵)が不足していて、糖が細胞の中に入れない。糖の取込みがうまくいかない。

2.インスリン抵抗性
インスリン(鍵)があっても、細胞のドアのたてつけが悪いため、開きにくい。効率よく糖を取り込めない。
糖尿病の症状ってどんなもの?
症状がなく糖尿病になっていることに気がついていない方も多くいます。糖尿病では、かなり血糖値が高くなければ症状が現れません。
高血糖における症状は、
- 喉が渇く、水をよく飲む
- 尿の回数が増える
- 体重が減る
- 疲れやすくなる
などです。



さらに血糖値が高くなると、
- 意識障害
に至ることもあります。
症状がまったくないまま健診などで糖尿病が判明する方もいれば、急に高血糖の症状が現れて糖尿病が判明する方もいます。また、眼や腎臓の合併症の症状が現れて、初めて糖尿病と診断される方もいます。糖尿病の診断について、詳しく知りたい方は 糖尿病は早くみつけましょう をご覧ください。
糖尿病は、その成りたちによっていくつかの種類に分類されますが、大きく分けると「1型糖尿病」、「2型糖尿病」、「その他の特定の機序、疾患によるもの」、そして「妊娠糖尿病」があります。
1型糖尿病
1型糖尿病では、膵臓からインスリンがほとんど出なくなる(インスリン分泌低下)ことにより血糖値が高くなります。生きていくために、注射でインスリンを補う治療が必須となります。この状態を、インスリン依存状態といいます(表1:1型糖尿病と2型糖尿病の特徴)。
詳しくは、1型糖尿病をご覧ください。
2型糖尿病
2型糖尿病は、インスリンが出にくくなったり(インスリン分泌低下)、インスリンが効きにくくなったり(インスリン抵抗性)することによって血糖値が高くなります(表1:1型糖尿病と2型糖尿病の特徴)。2型糖尿病となる原因は、遺伝的な影響に加えて、食べ過ぎ、運動不足、肥満などの環境的な影響があるといわれています。(こんな人は糖尿病に気をつけて)
すべての2型糖尿病患者の方に生活習慣の問題があるわけではありませんが、血糖値を望ましい範囲にコントロールするためには、食事や運動習慣の見直しがとても重要です。飲み薬や注射なども必要に応じて利用します。
表1:1型糖尿病と2型糖尿病の特徴
|
1型糖尿病 |
|
2型糖尿病 |
|
若年に多い |
発症 |
中高年に多い |
|
急激に症状が現れて、糖尿病になることが多い |
症状 |
症状が現れないこともあり、気が付かないうちに進行する |
|
やせ型の方が多い |
体型 |
肥満の方が多いが、やせ型の方もいる |
|
膵臓でインスリンを作るβ細胞という細胞が壊れてしまうため、インスリンが膵臓からほとんど出なくなり、血糖値が高くなる |
原因 |
生活習慣や遺伝的な影響により、インスリンが出にくくなったり、インスリンが効きにくくなったりして血糖値が高くなる |
|
インスリンの注射 |
治療 |
食事療法・運動療法、飲み薬、場合によってはインスリンなどの注射を使う |
その他の特定の機序、疾患によるもの
糖尿病以外の病気や、治療薬の影響で血糖値が上昇し、糖尿病を発症することがあります。

妊娠糖尿病とは、妊娠中に初めてわかった、まだ糖尿病には至っていない血糖の上昇をいいます。
糖は赤ちゃんの栄養となるので、多すぎても少なすぎても成長に影響を及ぼすことがあります。そのため、お腹の赤ちゃんに十分な栄養を与えながら、細やかな血糖管理をすることが大切です。
妊娠中は絶えず赤ちゃんに栄養を与えているため、お腹が空いているときの血糖値は、妊娠していないときと比べて低くなります。
一方で、胎盤からでるホルモンの影響でインスリンが効きにくくなり、食後の血糖値は上がりやすくなります。
多くの場合、高い血糖値は出産のあとに戻りますが、妊娠糖尿病を経験した方は将来糖尿病になりやすいといわれています。
詳しくは、妊娠と糖尿病をご覧ください。
参考:糖尿病の分類
- 1型(膵β細胞の破壊、通常は絶対的インスリン欠乏に至る)
- 自己免疫性
- 特発性
- 2型(インスリン分泌低下を主体とするものと、インスリン抵抗性が主体で、それにインスリンの相対的不足を伴うものなどがある)
- その他の特定の機序、疾患によるもの
- 遺伝子として遺伝子異常が同定されたもの
- 膵β細胞機能にかかわる遺伝子異常
- インスリン作用の伝達機構にかかわる遺伝子異常
- 他の疾患、条件に伴うもの
- 膵外分泌疾患
- 内分泌疾患
- 肝疾患
- 薬剤や化学物質によるもの
- 感染症
- 免疫機序によるまれな病態
- その他の遺伝的症候群で糖尿病を伴うことの多いもの
- 遺伝子として遺伝子異常が同定されたもの
- 妊娠糖尿病
参考:日本糖尿病学会:糖尿病の分類と診断基準に関する委員会報告(国際標準化対応版). 糖尿病55:490, 2012より
参考文献
- 日本糖尿病学会 編著:糖尿病診療ガイドライン2019. 南江堂, 2019
- 日本糖尿病学会 編著:糖尿病治療ガイド2022-2023. 文光堂, 2022
診断と検査
糖尿病は突然診断されるわけではありません。ここでは、糖尿病と診断されるまでの流れや診断に至る経過の具体例、糖尿病に関係する検査項目についてお話しします。こちらを読んで、症状を自覚している方は医療機関の受診をしていただき、そうでない方も健康診断や受診時の検査結果を理解するための助けになればと思います。
糖尿病は早く見つけましょう
2015年10月27日掲載2016年5月31日改定版掲載
2型糖尿病の方の血糖値は、ある日突然高くなるというのはまれで、多くの場合、患者さんが知らないうちにだんだん高くなってきます。
ここでは、症状がない糖尿病がどのように見つかって診断されるのか、患者さんが診断に至ったきっかけについて例をあげてお話しいたします。
目次
糖尿病がわかるきっかけ

早い時期に見つけて、血糖コントロールをすると、糖尿病の合併症を防ぐことができます。健康診断は、糖尿病を見つける、一番身近な方法です。
糖尿病の予備群や、メタボリックシンドロームについても、早めに気が付いて食事療法や運動療法を行うと、糖尿病の発症を防ぐことができます。
ほかにも、糖尿病とわかるきっかけはさまざまです。
- 献血に行ったら、糖尿病の疑いと言われた
(献血では、血糖の指標であるグリコアルブミンを検査します。) - 高血糖の症状がでた
- 糖尿病の合併症がわかった時に、初めて糖尿病を指摘された
(糖尿病の急性合併症、糖尿病の慢性合併症) - 妊娠をした時に高血糖が見つかった
などがありますが、高い血糖値がからだに悪い影響を及ぼす前に、早く見つけて、生活習慣の改善や治療をするのが理想です。
定期的に健康診断を受けて、糖尿病や糖尿病の予備群を早くみつけましょう。
糖尿病の予備群と言われたら、生活習慣を見直しましょう。
糖尿病と診断されたら、医師の診察を受けた上で、定期的に検査と治療を受けましょう。
血糖値とHbA1c
高い血糖値が続いていれば、糖尿病と診断します。
具体的には、血液の検査でわかる血糖値とHbA1c(ヘモグロビン・エーワンシー)が基準値より高いかどうかで診断します。
|
血糖値 |
検査したその時の、血糖の濃度を表します |
|
HbA1c |
過去1,2か月分の血糖値のあらましを反映します |
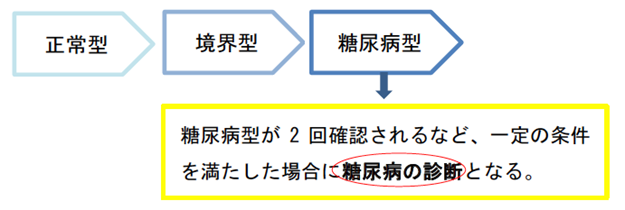
正常型・境界型・糖尿病型
多くの場合、糖尿病になるときは、ある日突然、血糖値が高くなるのではありません。
はじめは正常範囲の血糖値だったのが、少し高くなり、徐々に糖尿病の範囲まで高くなってきます。
正常から糖尿病になるまでの段階は、血糖値の高さで、正常型、境界型、糖尿病型と3段階に分類されます。糖尿病型が2回確認できる、など一定の条件を満たして初めて、糖尿病と診断されます。
空腹時血糖が正常でも、食後血糖が高い「隠れた糖尿病」があります。隠れた糖尿病を発見するためには、75g経口ブドウ糖負荷試験という詳しい検査を行います。
糖尿病の診断の具体例
次のうち、どれか1つでも満たした方は、糖尿病の疑い(糖尿病型)です。糖尿病型には、下記以外の基準もあります。
- 空腹時血糖値(10時間以上絶食後の、早朝空腹時の血糖値)126mg/dL以上
- HbA1c 6.5%以上
「糖尿病型」が同日または別の日に2つ確認されると糖尿病の診断となります。
「糖尿病型」をみとめた方は、できるだけ早く医療機関を受診しましょう。
注:糖尿病の診断について、さらに詳しい方法を知りたい方は糖尿病の新しい診断基準をご覧ください。
糖尿病の診断のための検査を行った実際の例を、いくつか見てみましょう。
60歳女性 Aさんの場合
空腹時血糖値とHbA1cの結果で、1日の検査で糖尿病の診断がついた。
職場の健康診断で空腹時血糖値が140mg/dL、HbA1cが8.0%であり、医師から「糖尿病の診断です」と言われました。
54歳女性 Bさんの場合
1回目の検査で糖尿病が疑わしく、75gブドウ糖負荷試験で糖尿病と診断された。
健康診断では、空腹時血糖値が115mg/dL、HbA1c6.5%でした。「糖尿病の可能性がある」ため、さらに詳しい検査を勧められました。後日、病院で75g経口ブドウ糖負荷試験をしたところ、空腹時血糖値が110mg/dL、2時間値が285mg/dLと高い値であり、糖尿病の診断となりました。
このように、75g経口ブドウ糖負荷検査2時間値(糖を飲んだ後、2時間の血糖値)が200mg/dL以上でも、やはり糖尿病型です。
40歳男性 Cさんの場合
1回目の検査で「糖尿病の疑い」といわれ、2回目の検査で糖尿病の診断となった。
高血圧でかかりつけだったクリニックを受診したところ、血液の検査で血糖値が250mg/dLでした。糖尿病の疑いがあると言われ、2週間後に再び受診したところ、血液の検査で空腹時血糖が135mg/dLであり、糖尿病の診断となりました。
このように、随時血糖値(食事のタイミングに関係なく測った血糖値)が200mg/dL以上でも、やはり糖尿病型です。
糖尿病型には最初に述べた2つの基準を含め、このように4つの基準があります。
糖尿病の診断は1回の検査では分からないことがあります。そのため、糖尿病の疑いと言われたときは、「疑いだから」、と油断しないで、できるだけ早く再検査に行きましょう
また、次の例のように、高い血糖値が続いた場合に起きる、糖尿病に特徴的な症状や網膜症も診断の手がかりとなります。
35歳男性 Dさんの場合
糖尿病の典型的な症状と、血糖値の結果で糖尿病の診断となった。
最近2週間くらい、喉が渇いて清涼飲料水やジュースなどをたくさん飲んでいました。尿がたくさん出て、何度もトイレに行きます。疲れやすくて、体重も少しずつ減ってきました。心配して病院に行ったところ、「糖尿病に典型的な症状ですね」と言われました。血糖値が350mg/dLと高く、すぐに糖尿病の診断になりました。
糖尿病の症状をみとめる方も、早めに医療機関を受診しましょう。
糖尿病に関する統計・調査と社会的な取組み
2019年10月15日掲載
糖尿病がある方の人数は日本のみならず世界的に増えており、国や世界の機関はその対策に尽力しています。
糖尿病がある方がどれだけいてどのような状態にあるか、治療にかかる費用はどれくらいかなどを把握することは、糖尿病の対策を立て、その効果を評価するために重要なことです。
ここでは、糖尿病に関する制度・統計や社会的な課題についてのはなしをします。
目次
日本では糖尿病がある方が増えていることが問題になっています。
糖尿病は眼や腎臓、心臓や脳血管など以前から関連があるといわれていた合併症のほか、最近ではがんや歯周病など糖尿病以外のさまざまな病気ともかかわるといわれています。さらに糖尿病性腎症は特に医療費のかかる人工透析の原因になることから、重症化予防が大きな課題と考えられています。(網膜症、大血管症、がん、糖尿病と歯周病の深い関係)
そこで、国は糖尿病を重要疾患のひとつとして位置づけています。
国民の健康を守るために、行政や私たち一人ひとりが健康増進へ向けた努力をしましょうという法律(健康増進法)がありますが、これに基づいた健康日本21(第二次)と呼ばれる「国民の健康の増進の総合的な推進を図るための基本的な方針」の中で、糖尿病は対策を講じるべき疾患として具体的な数値目標(表1:糖尿病の発症予防と重症化予防の徹底に関する目標)を定めています1)。
また、医療法という法律では、各地域で適切な医療体制を整えるために、各都道府県で「医療計画」という指針を作成するように定めています。この「医療計画」を作成する際には、特に重点的に対策を練るべき5疾病5事業(+在宅医療)(表2:5疾病5事業および在宅医療の内容)が指定されており、糖尿病はこの重点項目のひとつです2)。
このような国の方針のもと、国立国際医療研究センターに設立された糖尿病情報センターは糖尿病に関する情報を多くの方へ発信しています。
表1:糖尿病の発症予防と重症化予防の徹底に関する目標
|
項目 |
現状 |
目標 |
|
①合併症(糖尿病腎症による年間新規透析導入患者数)の減少 |
16,247人 |
15,000人 |
|
②治療継続者の割合の増加 |
63.7% |
75% |
|
③血糖コントロール指標におけるコントロール不良者の割合の減少(HbA1c8.4%以上の者の割合の減少) |
1.2% |
1.0% |
|
④糖尿病有病者の増加の抑制 |
890万人 |
1000万人 |
|
⑤メタボリックシンドロームの該当者および予備群の減少 |
1,400万人 |
平成20年度と比べて25%減少 |
|
⑥特定健康診査・特定保健指導の実施率の向上 |
特定健康診査の実施率41.3% |
平成25年度から開始する第2期医療費適正化計画に合わせて設定 |
(健康日本21(第二次)「国民の健康の増進の総合的な推進を測るための基本的な方針」より、一部改変)
表2:5疾病5事業および在宅医療の内容
|
5疾病 |
がん、脳卒中、急性心筋梗塞、糖尿病、精神疾患 |
|
5事業 |
救急医療、災害時における医療、へき地の医療、周産期医療、小児救急医療を含む小児医療(その他都道府県知事が当該都道府県における疾病の発生の状況等に照らして特に必要と認める医療) |
|
在宅医療 |
居宅等における医療 |
(厚生労働省:医療計画(第7次)「疾病・事業及び在宅医療に係る医療体制について」より作成)
日本には糖尿病がある方はどれくらいいるの?
糖尿病有病者と糖尿病予備群は合わせて約2,000万人いるといわれています3)。
平成28年「国民健康・栄養調査」では、糖尿病が強く疑われる者(糖尿病有病者)、糖尿病の可能性を否定できない者(糖尿病予備群)はいずれも約1,000万人(合わせて約2,000万人)と推計されています(図1:「糖尿病が強く疑われる者」、「糖尿病の可能性を否定できない者」の割合の年次推移)。糖尿病が強く疑われる者(図中青色)の人口に対する割合は男性16.3%、女性9.3%であり、年齢が高いほど糖尿病有病者の割合が高くなる傾向にあります。また糖尿病有病者の割合は最近20年間で増加傾向にあります3)。
詳しい統計の結果は厚生労働省:平成28年「国民健康・栄養調査」の結果をご参照ください。
図1:「糖尿病が強く疑われる者」、「糖尿病の可能性を否定できない者」の割合の年次推移
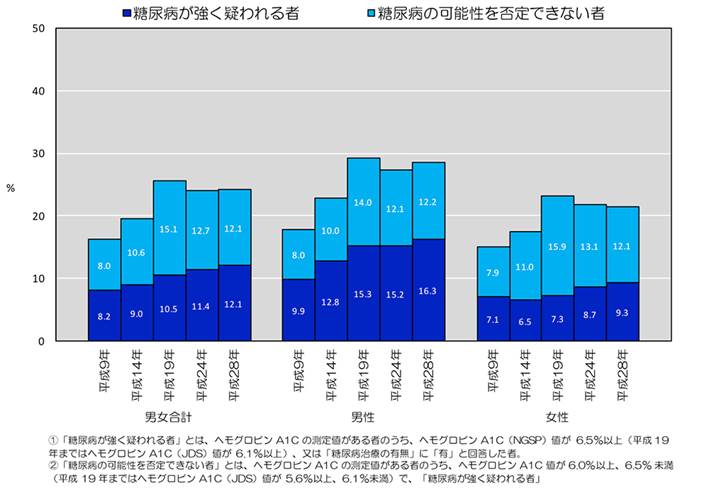 平成28年「国民健康・栄養調査」の結果 結果の概要より引用
平成28年「国民健康・栄養調査」の結果 結果の概要より引用
正確な人数を把握することの難しさ
糖尿病の患者数については、厚生労働省が実施する「国民健康・栄養調査」で測定される「糖尿病が強く疑われる者」の人数や、「患者調査」という方法で調べられる医療機関において糖尿病で治療を受けた患者数が参考にされています。実際にすべての糖尿病の患者数を数えたわけではなく、一部の集団で求めた患者の割合を国民の総数にあてはめて推計として算出しています。
このような推計には限界があり、必ずしも正確ではない可能性が指摘されています。例えばがんに関しては、"全国がん登録"といって発生したがん患者を全数登録するシステムが整っており、患者数を正確に数えることが可能です。一方このように数える仕組みを整えるには人件費などがかかりますので、糖尿病を含む多くの疾患では、実際に全患者数を登録することをしていません。そのため、より正確な数を推測するためには、多くの視点から統計をとって比較すること、それぞれの統計の精度向上に努めることが重要と考えられています。
糖尿病がある方の多くは、健康診断で血糖値の異常を指摘される、他の病気で医療機関を受診した際に高血糖を指摘されるなどして、糖尿病と診断されます。また、糖尿病の症状(喉の渇き、多尿、体重減少など)を感じて医療機関を受診し、糖尿病と診断される場合もあるでしょう。糖尿病と診断された方は薬の使用にかかわらず、合併症の予防のために食事療法や運動療法を行い、医療機関の受診を継続することが望ましいとされています。
しかしなかには、検査を受けないまま糖尿病であることに気づいていない方や、診断されたのち治療を開始したにもかかわらず受診を続けられず治療を中断する方もいます。
健康診断を受けましょう
糖尿病の予備群や糖尿病を早期に見つけるためには、定期的な健康診断が大切です。健診を何年も受けずにいると糖尿病になっていることに気づかず、悪化させてしまう場合があります。
そこで、日本では40歳以上74歳までの方が受診できる特定健診(メタボ健診)が実施されており、この検査には糖尿病の検査も含まれています。しかし残念ながら、実際に受診されている方は50%程度といわれています4)。利用している保険制度によって健診の実施率は異なりますが、会社に勤めている方の集団では実施率が50~90%と高率である一方、自営業の方・女性・若い方の場合は実施率が2~4割程度と低くなっています4)。該当する年齢の方は、会社や住んでいる自治体からの案内をよく確認し、年に1回は健診を受けましょう。
働きざかりの方ほど受診できていない
平成28年「国民健康・栄養調査」の結果では糖尿病患者の4人に1人は治療を受けていないことがわかっています(図2:「糖尿病が強く疑われる者」における治療の状況)。この中には、糖尿病の状態にあるにもかかわらず診断を受けていない方と、診断を受けたにもかかわらず治療を続けていない方が含まれます。年代別にみると40歳代男性では治療を受けている割合が他の年代よりも低いことから、勤労世代の健診の受診率や治療の継続率を高めることが糖尿病診療の課題といえるでしょう。
図2:「糖尿病が強く疑われる者」における治療の状況
 平成28年「国民健康・栄養調査」の結果 結果の概要より引用
平成28年「国民健康・栄養調査」の結果 結果の概要より引用
治療を継続するために
一度受診をした方も、治療を途中で中断してしまう場合があります。
医療機関で糖尿病の治療を受けている方のうち、1年間で約8%が何らかの理由で糖尿病治療を中断していると推計されており5)、治療の継続が課題になっています。
受診を中断してしまうと血糖値の検査や治療上のアドバイスを受ける機会を逃してしまうだけでなく、糖尿病の合併症に早期に気づき、治療を開始することが難しくなることもあります。その方の病状や事情にもよりますが、一般的には2週間から3ヵ月ごとの受診が勧められます。仕事などの都合で平日の受診や頻繁な受診が難しい場合もあるでしょう。適切な受診間隔や治療計画とあわせて自分の状況についても医師・医療スタッフとよく相談し、受診を中断しないようにしましょう。
また、糖尿病がある方が治療を継続するためには、病院で行われる治療や自分の心がけだけではなく、糖尿病がある方々を支える社会の仕組みも重要です。
厚生労働省は「事業場における治療と職業生活の両立支援のためのガイドライン」を公表し、事業所において労働者が糖尿病の治療と仕事を両立できる体制の構築を勧めています。経済的・心理的な支援に加え、仕事・家庭と治療との両立など糖尿病がある方が治療を続けられる環境の整備を社会全体で考えていく試みが大切です。
働く方の糖尿病治療の工夫については、働く世代と糖尿病をご覧ください。
引用文献
1)厚生労働省:健康日本21(第二次)「国民の健康の増進の総合的な推進を図るための基本的な方針」
https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou_iryou/kenkou/kenkounippon21.html
(最終閲覧日:2019年8月16日)
2)厚生労働省:医療計画(第7次)「疾病・事業及び在宅医療に係る医療体制について」
https://www.mhlw.go.jp/file/06-Seisakujouhou-10800000-Iseikyoku/0000159904.pdf
(最終閲覧日:2019年8月21日)
3)厚生労働省:平成28年「国民健康・栄養調査」の結果
https://www.mhlw.go.jp/stf/houdou/0000177189.html
(最終閲覧日:2019年8月16日)
4)厚生労働省:2017年度 特定健康診査・特定保健指導の実施状況
https://www.mhlw.go.jp/stf/houdou/0000173038_00004.html
(最終閲覧日:2019年8月21日)
5)「糖尿病受診中断対策包括ガイド」作成ワーキンググループ:糖尿病受診中断対策包括ガイド.厚生労働科学研究「患者データベースに基づく糖尿病の新規合併症マーカーの探索と均てん化に関する研究-合併症予防と受診中断抑止の視点から」(H25-循環器等(生習)-一般-016)
http://human-data.or.jp/wp/wp-content/uploads/2018/07/dm_jushinchudan_guide43_e.pdf
(最終閲覧日:2019年8月16日)
参考文献
- 厚生労働省:事業場における治療と職業生活の両立支援のためのガイドライン
https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000115267.html
(最終閲覧日:2019年8月16日)
栄養不良と過栄養
■はじめに
栄養不良は栄養不足による低栄養状態で,栄養障害ともいう.必要量よりも栄養摂取量が少ないとしだいに栄養不良になる.必要量は年齢,性別,体格などに関係する基礎エネルギー消費量や,活動量やストレスによって異なる.感染症や外傷,手術などのストレス(侵襲)があると,消費量が増えることにより必要量も増えるので,相対的に供給量が不足して栄養不良になりやすい.近年の高齢化社会においては,特に筋肉量の減少がサルコペニアとよばれ,日常生活の障害要因として問題となっている.
過栄養による肥満は,糖尿病,脂質異常症(高脂血症),高血圧症の原因となり,これらはメタボリックシンドロームとよばれ,動脈硬化,特に心血管障害の重大なリスク因子である.
■栄養不良と原因
栄養は健常時には経口的に摂取する.食事の量や内容が不足すると栄養不良になる.食料が不足する原因としては,発展途上国における紛争,飢饉などがあるが,現代の日本では虐待や,孤立した独居の高齢者などが問題となる.
臨床では,①食物の経口摂取困難,②消化管の通過障害,③消化吸収障害,④悪性腫瘍や代謝異常,⑤高度侵襲,⑥医原性などが栄養不良の原因となる(表Ⅰ).
食料があっても食べられない原因には,認知症,神経性食欲不振症候群などの精神疾患があげられ,そもそも食物を口に入れないケースがある.意識障害患者は当然ながら経口摂取はできない.口に入れても咀嚼や嚥下機能に障害のある場合も食べることができない.嚥下障害の原因としては,脳血管障害や頭部外傷とその後遺症,神経筋疾患がある.

口から肛門までの消化管のどこかに通過障害があると,食物が通らないので栄養摂取ができない.通過障害の原因としてはがんなどの腫瘍による閉塞がある.腫瘍は徐々に大きくなるので,通過障害も徐々に出現する.食道はもともと細いことと,食物がまだ固まりで通ることから,食道がんでは食物がつかえたり嚥下困難が生じる.このため食道がんや噴門部がんが進行すると栄養障害になりやすい.アカラシアや逆流性食道炎も重症になると,食道狭窄から通過障害をきたす.
胃は内腔が広いが幽門の部位は狭いので,幽門付近のがんや十二指腸潰瘍の瘢痕狭窄などで通過障害をきたすと,胃の内容物が排出しにくくなり,胃の膨満や嘔気・嘔吐が生じるので,しだいに食べられなくなる.
大腸がんは近年増えているが,上部消化管がんに較べると栄養不良患者は少ない.大腸の内容物は液状から泥状であり,S状結腸や直腸に至って固形便になる.ゆえにかなり内腔が狭くなって,腸閉塞のような状態にならない限り経口摂取量は減らない.
上腸間膜動脈血栓症や絞扼性イレウス,腹部外傷による腸管損傷などで小腸を大量切除した短腸症候群や重症のクローン病では,消化吸収障害から栄養不良になりやすい.
悪性腫瘍の末期にはがん性悪液質という代謝異常状態になり,強制栄養を行っても栄養状態は改善せずに栄養不良に至る.肝硬変の末期にも肝臓での栄養素の代謝ができなくなるので栄養不良になる.
外傷や手術と感染症は特に重症では高度侵襲になり,多くのストレスホルモンやサイトカインも分泌される.侵襲に耐えて回復するためには大量のエネルギーを必要とする.損傷部位の修復にはタンパク合成が必要であり,体脂肪や骨格筋を分解してエネルギー源として利用する.高度侵襲下では需要に匹敵する栄養供給は困難であり,エネルギー需要の増大と体脂肪・体タンパクの分解の亢進は栄養状態を低下させる.
入院治療中に栄養摂取が不足しているにもかかわらず,適切な栄養投与ができていないことが少なからずあり,長期間になると医原性の栄養不良となる.
■過栄養と原因
栄養状態は,消費量に比して摂取量が適切であれば恒常性を保ち,少なければ低下して低栄養になり,過剰であれば過栄養となる.過栄養も低栄養も身体の機能維持には不都合であり,長期間にわたるほど何らかの健康障害を引き起こす.特に日本人は欧米人よりも肥満によって糖尿病などになりやすい.高齢者は低栄養が多いとされるが,食生活の欧米化と車社会における運動不足などの社会的要因で,肥満,メタボリックシンドロームなどの過栄養も見受けられるようになってきた.
肥満や糖尿病は最近の30年で急激に増加しているが,昭和30年代と最近の日本人の1日の摂取総エネルギー量はほとんど変わっていない.しかし,食事の内容は,かつては米飯と,芋,豆などの食物繊維の豊富な野菜類,青魚などが多かったのに対して,近年は清涼飲料水,菓子,果物などの単純糖質を多く含む甘いものや,動物性脂肪の摂取割合が多くなっている.
昔は地方の交通手段が徒歩や自転車であったが,今はすぐ近くに行くにも自動車で移動するのに加えて,地方でも食生活が欧米化しているので,肥満が増えていると考えられる.
関連キーワード
· [3] メタボリックシンドローム[metabolic syndrome]
栄養不良が引き起こす問題
■はじめに
過栄養は脳卒中や心血管疾患で突然死を引き起こす,あるいは後遺症が残る,糖尿病で腎不全になるなどのリスクはあるが,過栄養そのものは,太りすぎで手術がしにくい,術後高血糖,肺梗塞,無気肺などになるリスクが高い程度であり,肥満のみが原因で,すなわち太りすぎただけで死ぬことはまずない.余分なエネルギーを蓄えているので,入院や手術を契機に体重が減ると,腰痛や膝痛が軽減したり,糖尿病が改善することさえある.
一方で栄養不良はやせ細るだけでなく,侵襲に対するエネルギーの備蓄がないことと免疫能も低下していることから,過栄養よりも危険なことが多い.栄養不良状態では感染症に罹患しやすく,創傷治癒も遷延する.免疫担当細胞もエネルギー不足で感染抵抗力が弱まっている.
創傷治癒には肉芽の増殖などが必要であるが肉芽組織もタンパク合成でつくられるので,エネルギーやタンパク質が不足していると創傷はなかなか治らない.ゆえに栄養不良患者は術後合併症を発生しやすく,創傷や疾患が治りにくい.るい痩(痩せ)による皮膚の脆弱化や皮下組織の菲薄化と骨突出もあるので褥瘡もできやすい.
栄養不良による合併症により在院日数が長くなれば,医療費も増加し,患者の社会復帰も遅れる.
■栄養不良と感染
栄養不良が高度になると,骨格筋タンパクは分解して消費され,骨格筋タンパクに多く含まれる分岐鎖アミノ酸のバリン,ロイシン,イソロイシンも消費されて低下する.さらにタンパク合成能も低下するので,血漿タンパクのアルブミンや免疫機能に重要なタンパクのグロブリン,さらにグルタミン,アルギニンなどの免疫機能に関与するアミノ酸も低下する.感染防御に重要な末梢リンパ球数も減少する.
グルタミンは腸管免疫能に大事な小腸粘膜の維持に必要なアミノ酸であるため,グルタミンの欠乏は腸管免疫能を低下させる.
このような免疫能の低下により術後肺炎や創感染などの感染性合併症を起こしやすくなる.消化器がん患者の術後合併症に関しては,縫合不全の原因は手術手技上の問題によることが多いが,術後肺炎などの感染性の合併症は術前栄養不良患者でリスクが高い(参考文献1-2-1).
栄養不良患者は抗がん薬によるがん化学療法や放射線治療を行う際にも感染症になりやすいので,がん治療にも支障をきたす.
■栄養不足と栄養不良
独居高齢者が動けなくなって発見されたケースや,精神疾患で長期に摂食していなかった場合,虐待などは別として,現代の日本社会で暮らしていて食べられないことが原因で栄養不良になることはまずない.
実際の栄養不足は,病気での入院中や,経口摂取ができない病状での在宅療養の患者に対し,適切な栄養補給が行われない場合に起こることも多い.大きな手術や外傷などでは,高度侵襲の影響で身体成分の消費が起こり,さらにストレスホルモンやサイトカインの分泌亢進で,より多くのエネルギーが必要となる.加えて高度侵襲下の病態では絶食または経口摂取が不十分な状態であることが多い.ゆえに静脈栄養や経腸栄養で必要十分な栄養補給が行われなければ,栄養不良となり回復ができない,あるいは合併症が発生するなどの予後不良状態になりうる.
脳卒中後遺症などで経口摂取が不能な場合は,胃瘻などからの経管経腸栄養が長期になることがあり,在宅療養となるケースも多い.必要十分な量と内容の栄養が投与されなければ,徐々に栄養不良状態となる.特に長期の栄養管理においては,各種必須栄養素の欠乏症による栄養障害には注意が必要である.
関連キーワード
· [2] リフィーディング症候群[refeeding syndrome]
栄養療法の考え方とその効果
■はじめに
栄養療法は栄養不良を改善することで,各種疾患や合併症の予防や治療になり,予後や全身状態と生活の質(QOL)を改善する.栄養療法は体力をつけて病気を回復させる自然治癒の基礎的治療法であり,副作用もなく万病に効く.しかも栄養剤や輸液製剤は,他の薬剤に比べて安価で経済的でもある.
栄養サポートや栄養ケアは医療と療養の基本となる療法であり,栄養不良の早期発見と適切な栄養サポートが,合併症の予防や早期回復につながる.栄養サポートには医師,薬剤師,管理栄養士,看護師,言語聴覚士,臨床検査技師などの多職種が連携するチーム医療が必要かつ効果的である.そのため,栄養サポートに関するチーム医療に診療報酬でも加算が認められている.
■栄養療法の手段
経口摂取が可能であるのに食事内容が栄養不良の原因であるときや,咀嚼や嚥下機能に多少の問題があっても食形態の工夫で食べられるケースでは,管理栄養士の栄養指導や,歯科医師や言語聴覚士と看護師,管理栄養士の協力により経口のみで栄養摂取が改善できることも多い.
経口摂取が不可能でも消化管機能(小腸の消化吸収能)に異常がなければ,経管経腸栄養を行う.脳血管障害の急性期など短期間の場合は経鼻経管栄養が行われるが,経鼻チューブは不快であり,交換の際に気管に誤挿入するリスクもあるので,長期になる場合は胃瘻からの経腸栄養がよい.
消化器がんの術後などの短期間の絶食期間は,水分電解質補給が主目的であるので末梢静脈栄養が行われる.2週間以上の絶食で経腸栄養もできない場合は,高カロリー輸液が必要なので中心静脈栄養を行う(参考文献1-3-1).
中心静脈カテーテル留置経路に関しては,鎖骨下静脈は気胸,内頸静脈は動脈誤穿刺,大腿静脈は便尿汚染による感染などのリスクがある.末梢挿入式中心静脈カテーテル(PICC:peripherally
inserted central catheter)は,これらのリスクがなく,最近はエコーガイド下に上腕から挿入できるので肘部での屈曲がなくなり,さらに診療看護師の特定行為として熟練した看護師が挿入できるようになったので,安全な経路として第一選択になりつつある(参考文献1-3-1).
栄養療法(栄養サポート)はかつては主治医一人に一任されていたので,主治医が栄養に興味や知識がなければ,栄養不良や栄養障害に陥ることも見受けられた.しかも原疾患の治療に加えて,栄養指導や管理栄養士への依頼,静脈栄養や経腸栄養の栄養投与経路の造設やその手配も主治医が行っており,医師の負担が大きかった.近年はチーム医療が普及して診療報酬加算での評価も後押しする形で,栄養療法も栄養サポートチーム(NST)が適切なサポートやアドバイスを行うようになっている(参考文献1-3-2).
■栄養療法の効果判定
栄養療法の効果判定は,週に1回はするべきである.最も簡単かつ大事なのは患者状態の観察である.血清アルブミン値などの血液検査データに変化がなくても,患者が元気になっていれば有効と考える.体重変化は最も簡便な指標であるので必ず測定する.
効果が認められなければ,栄養投与法や摂取量や内容を再検討する.栄養療法に問題がなくても,原疾患が治癒傾向にない,もしくは悪化していれば栄養状態も改善しないことが多い.栄養改善だけで治りが早くなる病状もあるが,反対に感染症などは原疾患が治れば栄養状態も改善するので,原疾患の治癒過程や病状に応じた適切な栄養療法が必要である.
がん性悪液質の末期や老衰では,強制栄養がかえって苦痛を強いることもあるので,栄養療法の適応の判断が求められる.
NSTは少なくとも週に1回はミーティングとラウンドを行っているので,チームが介入した栄養サポートの効果を毎週判定する.改善すればチームのモチベーションも向上する.また栄養療法による病状の改善のみならず,感染対策,褥瘡対策,緩和ケアの知識についてもディスカッションすることができて,チーム医療の質が向上する.
関連キーワード
· [1] 栄養サポートチーム(NST)[nutrition support team]
· [2] 栄養サポートチーム加算[additional medical fee for the nutrition support team activity]
· [3] 栄養ケアマネジメント[nutrition care and management]
運動療法との相乗効果
■はじめに
骨格筋は重要なアミノ酸プールであり,身体活動能力を維持するためには筋肉の質と量を保持することが必要である.医療の進歩で平均寿命が延びて高齢者が増えているが,高齢者のQOLは身体活動能力に大きく依存している.
■中年層の運動不足
近年の日本人は約50年前から摂取エネルギー量はほとんど変化がないにもかかわらず,中高年には内臓脂肪の蓄積したメタボリックシンドロームが増えている.内臓脂肪が蓄積して体重は多いにもかかわらず,足腰などの骨格筋については,質はいわゆる霜降り肉で,量も少ない傾向にあり,交通機関と自家用車の発達による歩行をはじめとする運動の不足が大きな要因と考えられる.このような中高年の肥満は心血管障害や脳血管障害のハイリスクであり,突然死の原因となり,救命できても後遺症で寝たきりになることも少なくない.
メタボリックシンドロームは短命と寝たきりのいわば時限爆弾であるが,現役世代にとって,将来のことまでも考える節制は容易ではない.不摂生と運動不足で太ることは容易であるが,食事療法と運動療法はよほど明確な目的と強い精神力が伴わなければ困難である.しかもいったん脂肪を蓄えた身体は動きが鈍く疲れやすいので運動が苦手になっている.肥満患者にとって太るのは簡単であるが痩せるのは修業であり,ヘビースモーカーの禁煙と同様に周囲のサポートは必須である.
食事を制限せずに運動療法だけでエネルギーを消費するには,かなりの量の運動をしなければならない.かえって食事療法だけで体重を減らす方が簡単である.しかし無理なダイエットは健康を損ねることもあり,リバウンドすることが多い.筋肉を大きくするとエネルギー消費量が増えるので,同じ量を食べても脂肪がつきにくくなる.筋肉は脂肪よりも同体積での質量が大きいので,筋肉を鍛えると同じ体重でも身体が引き締まる.
筋肉もタンパク質であり,筋タンパク合成にはエネルギーと窒素源(タンパク質やアミノ酸)の十分な補給が必要である.エネルギーと窒素源を適切に摂取せずに運動だけを行うと,疲労して体力を消耗することに加えて,脂肪は消費するが筋肉も分解されてエネルギー源として使われるので,体重は減るが筋肉も減ってしまう.運動と栄養補給は両方がバランスよく行われる必要がある(参考文献1-4-1).
■高齢者のロコモティブシンドローム
増加した高齢者は独居または老夫婦2人だけの世帯であることが多い.そのような家庭ではタンパク質の少ない食事に加えて出歩く機会の少なさから,痩せて筋肉も萎縮した状態で入院となるケースが多くなっている.
加齢による運動器機能不全はロコモティブシンドローム(運動器症候群)の最多を占める.筋肉が痩せて筋力が低下することに加えて,心肺機能の衰えから持久力も低下する.反射神経やバランスをとる能力も低下するので,さらに運動不足になり,家に閉じこもるという悪循環でフレイル(虚弱)とよばれる要介護の前段階に陥る.
フレイルは運動器を主とする身体機能の衰えのみならず,精神的要因も加わった社会的活動レベルの低下である.誤嚥して肺炎になりやすく,転倒しやすく,転倒すると骨折しやすい.インフルエンザや感染性腸炎など健康なら自然治癒することがほとんどの感染症でも,合併症や重症化で入院となりやすい.
記憶力や思考力などの精神機能の衰えや,視力,聴力,歯,排尿機能の低下,皮膚の皺や色素沈着,頭髪の脱毛は,栄養摂取や訓練とケアである程度は進行を遅らすことができるが,加齢に抗って若返ることはできない.しかし骨格筋だけは,年をとっても栄養摂取と筋力(レジスタンス)トレーニングで鍛え上げ,キープすることが可能である.
筋肉を増やして筋力を向上させることで運動能力が保てれば,活動性も向上する.その結果,精神的にも衰えを防ぐことができ,健康な状態で生活能力を維持したまま天寿をまっとうすることができる可能性が高くなる.
関連キーワード
· [3] 筋力(レジスタンス)トレーニング[resistance exercise]
代謝編 糖尿病
1 最も頻出な疾患 糖尿病 疫学 主症状 合併症 代謝機能の定義 フィジカルアセスメント
栄養素の消化・吸収
■消化とは
食物として日常摂取するものは,デンプンやタンパク質などの高分子化合物であり,そのままでは血液の中に取り込むことができない.そこで,血液に取り込むことができる低分子化合物まで分解する必要がある.このような食物の分解が消化である.なお消化された低分子化合物が体内に取り込まれることを吸収という.
消化器系は,口腔,食道,胃,小腸,大腸,肛門に至る消化管と肝臓,胆のう,膵臓などの付属器官からなる(図Ⅰ).
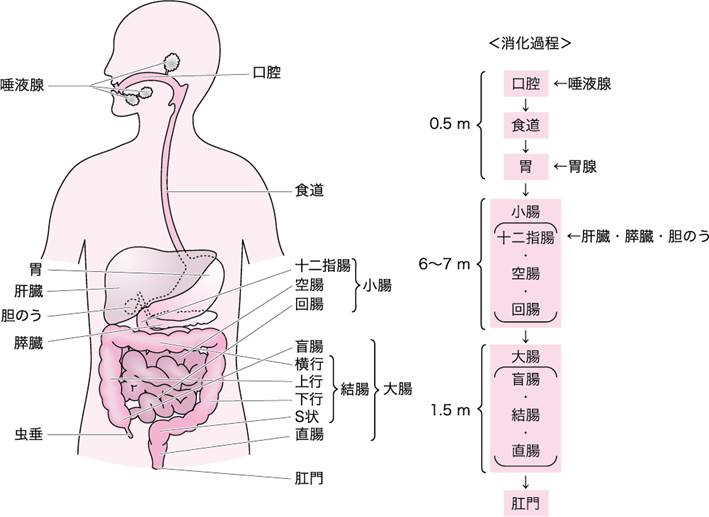
図Ⅰ●消化管と消化に関連する臓器
■消化の分類
消化には,唾液や胃液中に含まれる消化酵素による分解(化学的消化)だけでなく,口の中で食べものをかみ砕く消化(物理的消化)や,腸内細菌による消化(生物的消化)がある.
化学的消化とは,消化酵素の作用により食物成分が化学的に分解されることである.消化管内で食物の分解に働く酵素類は,唾液,胃液,膵液および腸液中に含まれている.唾液や膵液のpHは中性から弱アルカリ性であるのに対して,胃のpHは1~3で強酸性である.
物理的消化とは,食物が咀嚼によってかみ砕き,蠕動運動によって消化液と混合し,粥状,液状となることである.これには,消化の状態に応じて食物を次の部位に送り込むことも含まれる.
生物的消化は,難消化性食物成分が腸内細菌による発酵や腐敗などにより,分解されることである.主として大腸で行われている.
消化が行われる部位により,管腔内消化と膜消化に分類される.
食物は,管腔内消化で消化管内の消化酵素によって小分子化される.そのままでは吸収されないため,小腸粘膜において膜消化によってさらに分解され細胞内に吸収される.
■栄養素の吸収部位
消化によって,小分子に分解された栄養素は,消化管壁から吸収される.ほとんどすべての栄養素は,多数のしわと絨毛をもつ小腸粘膜の吸収細胞から吸収される(図Ⅱ).胃ではアルコールだけが吸収され,水分の吸収は主に大腸で行われる.
食後約2時間で小腸の吸収がはじまり,食後9時間までの間に栄養素の吸収はほぼ完了する.吸収されなかった残渣は大腸に送られてここに18時間以上とどまり,その間に水分が吸収されるのでしだいに固形の糞便となり,食後24時間程度で,肛門より排泄される.
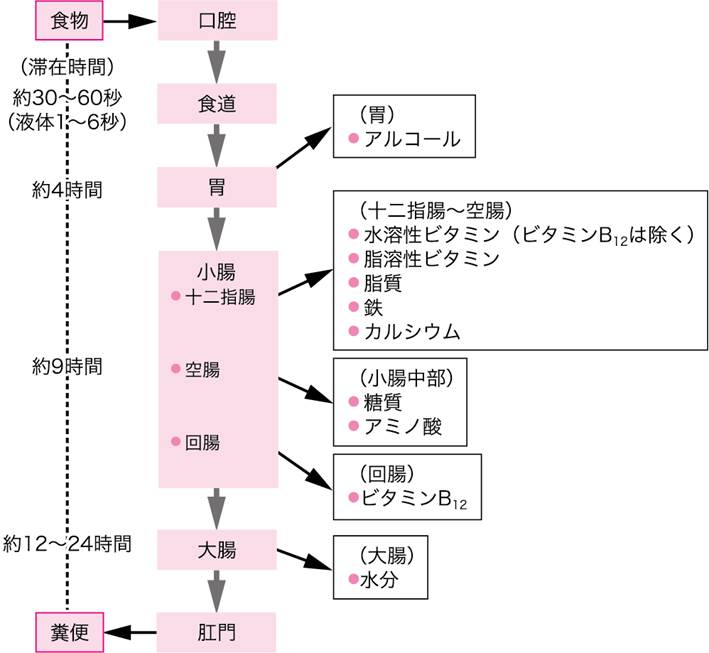
図Ⅱ●吸収部位
■栄養素の吸収の方法
栄養素が吸収されるためには,消化管壁を通過しなければならない.吸収のしくみは大きく2つに分けられる.1つは,高い濃度から低い濃度の方へと自然に移動するように栄養素を細胞内に取り込む方法であり,これを受動輸送という.もう1つは,ポンプを使って水を高い方へくみ上げるように,エネルギーを使って濃度の低い消化管内の物質を濃度の高い細胞内へ輸送する方法であり,これを能動輸送という.
■栄養素吸収の流れ
小腸粘膜上皮に吸収された栄養素は,その溶解性により異なった運搬経路をたどる.単糖類,アミノ酸,ミネラル(無機質),水溶性ビタミンなどの水溶性成分や,水と親和性のある短鎖・中鎖脂肪酸は毛細血管から門脈へ移行し,肝臓に運ばれる.
長鎖脂肪酸やグリセロールは,コレステロールや脂溶性ビタミンなどとともにリポタンパクの1つであるカイロミクロンに組み込まれてリンパ管に移行し,その後胸管を経て大動脈に入り全身に運ばれる.
関連キーワード
· [1] 管腔内消化と膜消化[intraluminal digestion and membrane digestion]
· [2] 受動輸送と能動輸送[passive transport and active transport]
糖質代謝
■糖質の種類と役割
糖質は,果実類,穀物類,乳製品に多く含まれ,人類の主要なエネルギー源である.糖質は植物の光合成によってつくられ,Cn(H2O)mの化学式をもつ化合物であることから,炭水化物と同義語として使われることが多い.
糖質は,その重合度(結合している単糖の数)によって3つに分類される.つまり①単糖類,②少糖類(重合度が2~10程度)および③多糖類(重合度が10を超える炭水化物)である(表Ⅰ).
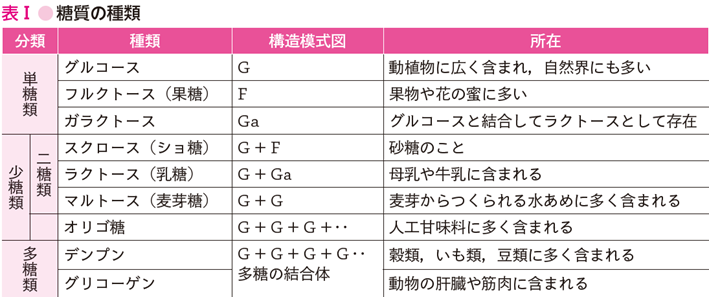
単糖類とは,グルコース,フルクトース,ガラクトースであり,天然には果実類,野菜類,蜂蜜に少量含まれている.少糖類は,単糖が2分子結合した二糖類が栄養学的に特に重要である.スクロースは,グルコースとフルクトースからなる二糖類で,テンサイやサトウキビから抽出される.ラクトースは,グルコースとガラクトースからなる二糖類で,天然にはミルクと乳製品のみに存在する.マルトースは,グルコース2分子からなる二糖類であり,デンプンの分解物として存在することが多い.トレハロースはきのこや昆虫の組織に多く含まれており,ヒトの小腸にはトレハロースを分解するトレハラーゼが存在する.オリゴ糖とは,3~9個の単糖類が結合したもので,グルコースが3個結合したマルトオリゴ糖などがある.多糖類は,グルコースの重合度が高く,構成する単糖類が十から数千にも及び,グルコースが多数結合した植物の貯蔵多糖であるデンプンと,動物の貯蔵多糖であるグリコーゲンがある.デンプンは穀類に多く含まれ,多く消費されている糖質である.デンプンには直鎖状のアミロースと枝分かれのあるアミロペクチンがある.グリコーゲンは,主に肝臓と筋肉に存在しアミロペクチンと似た枝分かれ構造となっている.
糖質の主な役割は,脳,神経組織,赤血球など,通常はグルコースのみをエネルギー源として利用している組織に,グルコースを供給することである.体内の代謝経路である解糖系や糖新生系が,これらの調節を行っている.
■糖質の消化と吸収
糖質の消化は,口腔内からはじまる.口腔内消化の特徴は咀嚼と嚥下である.口の中でかむことによって食物は粉砕され,α-アミラーゼを含む唾液と混合されることによって,デンプンが初期消化を受ける.口腔内の消化は比較的短く,食塊が食道を通り胃に到達すると,胃酸によってα-アミラーゼの酵素活性が失活する.その後,十二指腸において膵臓から分泌される膵α-アミラーゼにより,マルトトリオース,マルトース,イソマルトースおよび一部はグルコースまで分解される.これら少糖類および二糖類は,小腸粘膜の微絨毛に存在する二糖類水解酵素(マルターゼ,スクラーゼ,ラクターゼ)により単糖に分解され,それと同時に細胞内に吸収される(膜消化).膜消化により生じた単糖は,直ちに小腸粘膜上皮細胞に取り込まれ,門脈を介して肝臓に運ばれる(図Ⅰ).
消化直後の腸管内の遊離糖濃度は高く,小腸粘膜上皮細胞内に受動的に吸収されるが,遊離糖濃度が低下したときには濃度勾配に逆らった能動輸送が必要になる.グルコースとガラクトースはナトリウム/グルコース共輸送体であるSGLT1によって能動的に輸送される.一方,フルクトースの吸収は能動的であり,グルコース輸送体であるGLUTファミリーの一員であるGLUT5によって促進される.単糖類が小腸粘膜上皮細胞に入って基底膜側を通り,血液に入っていく動きは受動輸送で,GLUT2により細胞外に出て門脈に運ばれる(図Ⅰ).
■糖質の代謝
小腸で吸収された単糖類は,非インスリン依存性のGULT2輸送体によって肝臓に取り込まれる.単糖類のうちグルコースは,体内の細胞の多くでエネルギー源として利用される.グルコースの代謝の第一段階は,すべての細胞の細胞質で解糖系とよばれる経路にてATPと炭素数3のピルビン酸2分子を生成する.この後,好気的条件下では,ピルビン酸はミトコンドリア内に輸送され,脱炭酸を受けてアセチルCoAとなり,クエン酸回路に入っていく.この回路でグルコースは完全に異化されて,二酸化炭素と水を生じるとともに,補酵素(NAD+とFAD)を酸化し,これら補酵素が電子伝達系において大量のATPに変換される.
グルコースは,身体にとって主要なエネルギー源であり,組織に絶えずエネルギーを供給するため,血糖値を一定のレベル(70~100 mg/dL)に保っておくことが重要である.グルコースは,ピルビン酸,乳酸,グリセロールおよび多数のアミノ酸から合成が可能である.グルコースの生成は,基本的には解糖系の逆反応であり,これを糖新生系という.なお,糖新生は肝臓と腎臓に特異的な反応であり,これらで合成されたグルコースは血中へと放出され,すべての組織で利用される.
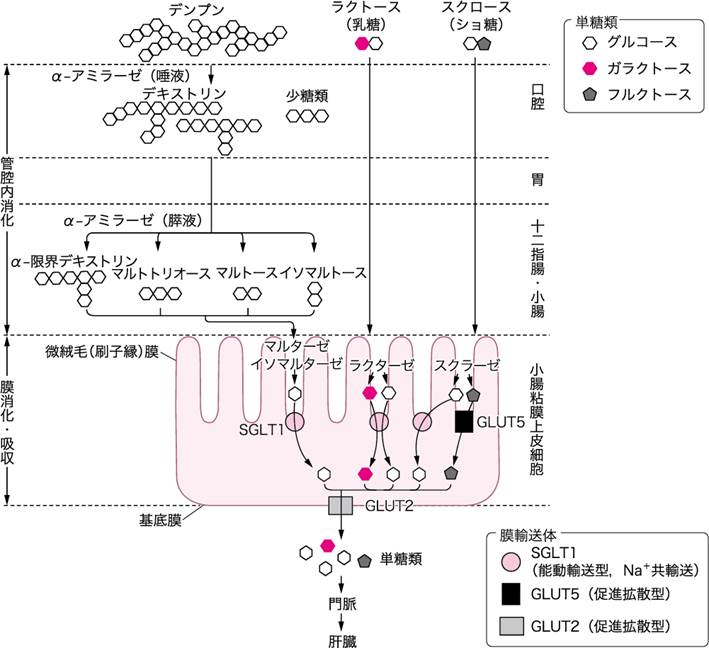
図Ⅰ●糖質の消化・吸収の流れ
(文献2-2-1より引用)
関連キーワード
· [2] クエン酸回路[citric acid cycle]
· [3] 電子伝達系[electron transport chain]
· [5] グリコーゲンの代謝[glycogen metabolism]
· [6] ペントースリン酸回路[pentose phosphate cycle]
· [7] グルクロン酸経路[glucuronic acid cycle]
· [8] グリセミック・インデックス[glycemic index]
タンパク質代謝
■タンパク質とは
タンパク質とは,生体の主要構成成分の1つであり,20種類のアミノ酸がペプチド結合により重合したポリペプチドを基本構造とする.ヒトでは体重の約15%をタンパク質が占め,酵素反応,筋収縮をはじめとして,物質輸送や防御反応などの化学反応などに関与している.このように,タンパク質は体構成成分として重要であるのに加え,1 gあたり4 kcalの燃焼値をもちエネルギー源としても重要である.
食事中のタンパク質は,その構成アミノ酸によって栄養価が異なり,特に必須アミノ酸がバランスよく含まれる動物性食品は,栄養価が高い.タンパク質は,加熱,凍結,酸,アルカリ,撹拌などにより変性し,これらの作用はタンパク質の機能や性質に影響を及ぼす.
■タンパク質の消化と吸収(図Ⅰ)
食事として摂取したタンパク質は,その構成要素であるアミノ酸,あるいはアミノ酸が2~3個結合しているだけの低分子物質(ジペプチド,トリペプチド)になってはじめて吸収される.
口腔内で機械的にかみ砕かれたタンパク質が最初に化学変化をする場所は,胃である.胃ではタンパク質分解酵素(消化酵素)のペプシンの作用により,タンパク質のペプチド結合が切断され,分子量の小さいプロテオース,さらにもっと低分子量のペプトンとよばれるポリペプチドまで加水分解される.
部分的に消化されたポリペプチドは幽門を通り,十二指腸に移行し,小腸内で膵液中に含まれる別のタンパク質分解酵素であるトリプシン,キモトリプシン,エラスターゼ,カルボキシペプチダーゼなどの作用を受ける.
小腸粘膜から吸収されるのは必ずしも1つひとつの遊離アミノ酸である必要はなく,2~3個のアミノ酸からなるジペプチドあるいはトリペプチドのままでも吸収される.
これらのペプチドは,小腸粘膜上皮細胞の微絨毛(刷子縁)膜の細胞質中の酵素(ペプチダーゼ)でバラバラにされて遊離アミノ酸となり,粘膜下組織の毛細血管から,門脈系を経て肝臓に運ばれる.
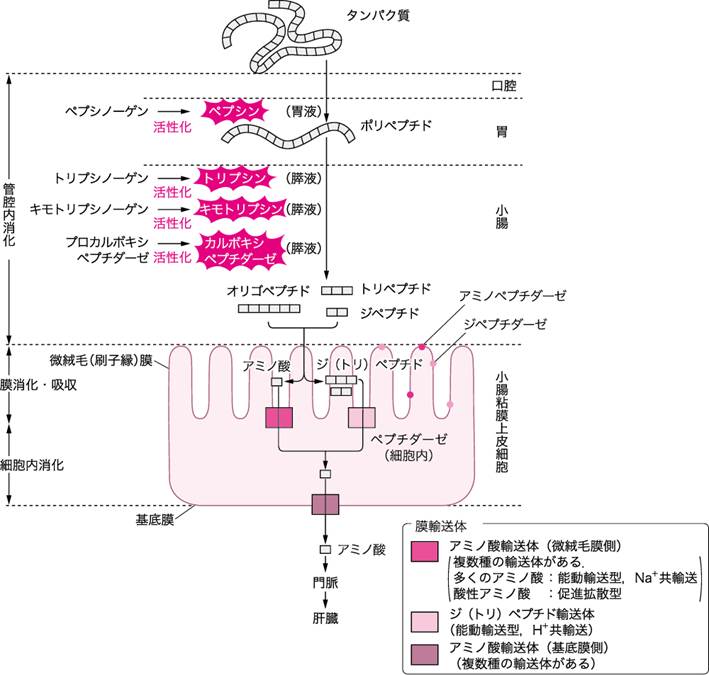
図Ⅰ●タンパク質の消化・吸収
(文献2-3-1より引用)
■アミノ酸の代謝(図Ⅱ)
食事により取り込まれたタンパク質は,アミノ酸となって吸収され,その一部は遊離アミノ酸として存在している.遊離アミノ酸は体内で一定量が蓄えられており,この蓄えをアミノ酸プールという.アミノ酸は主にタンパク質合成に利用されるが,タンパク質分解によって得られたアミノ酸が体タンパク質の合成に必要のないものの場合や必要量以上のアミノ酸が摂取された場合,また飢餓や糖尿病など糖質がエネルギー源として利用できない場合は,タンパク質が分解されエネルギー源として使われる.
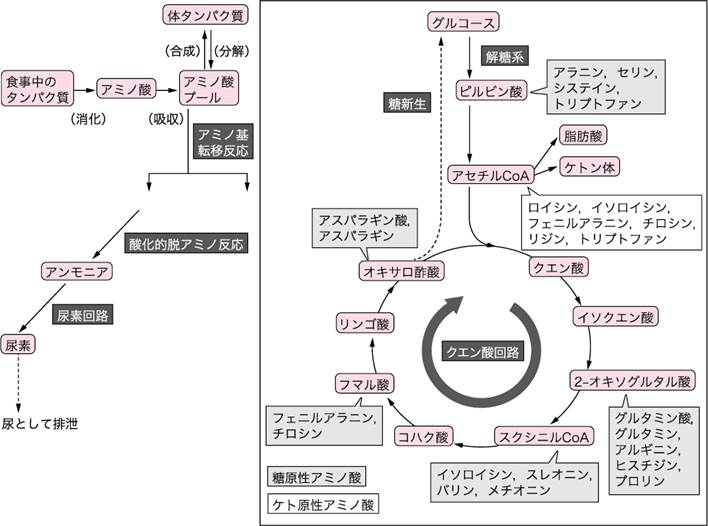
図Ⅱ●アミノ酸代謝の概要
糖質や脂質は完全に酸化されると,水と二酸化炭素になる.同様に,タンパク質(アミノ酸)中の炭素は,エネルギー源として酸化されて二酸化炭素となるが,アミノ酸のアミノ基は,有毒なアンモニア(NH3)になってしまう.そこで,エネルギーを消費しながら,肝臓でアンモニアを尿素に変換し,無毒化するしくみが備わっている.アミノ酸の窒素成分の代謝では,各アミノ酸は,まず2-オキソグルタル酸にアミノ基を転移してグルタミン酸となる.この反応をアミノ基転移反応とよんでいる.この反応には,肝機能検査として臨床診断でも使用されているアスパラギン酸アミノトランスフェラーゼ(AST)とアラニンアミノトランスフェラーゼ(ALT)が代表的な酵素として働いている.続いて,グルタミン酸に転移したアミノ基は,酸化的脱アミノ反応によってアンモニアとして遊離する.このアンモニアは,肝臓の尿素回路で尿素に変換され,最終的に尿中に排泄される.
アミノ酸からアミノ基が外れた炭素骨格は,糖代謝経路に合流する.合流場所は,ピルビン酸,アセチルCoA,クエン酸回路の3カ所である.主にピルビン酸に合流するアラニンとセリンや,クエン酸回路に入るグルタミン酸とアスパラギン酸などのアミノ酸はグルコースをつくり出す(糖新生)ため,糖原性アミノ酸という.ロイシン,イソロイシン,フェニルアラニン,チロシンはアセチルCoAから脂肪酸やケトン体になるため,ケト原性アミノ酸という.なお,ロイシンとリジン以外のケト原性アミノ酸は,糖原性アミノ酸でもある.
関連キーワード
· [2] アミノ酸スコア[amino acid score]
· [3] タンパク質の構造[protein structure]
· [4] 分岐鎖アミノ酸(分枝アミノ酸)[branched-chain amino acid]
· [5] 窒素出納(窒素バランス)[nitrogen balance]
· [7] チロシン代謝[tyrosine metabolism]
· [8] アミノ酸代謝異常症[amino acid metabolism disorders]
脂質代謝
■脂質とは
脂質は重要なエネルギー補給源および貯蔵体として,1 g当たり9 kcalで,糖質やタンパク質(ともに,1 g当たり4 kcal)に比べてエネルギー密度が高い.さらに脂質は,必須脂肪酸の供給源,脂溶性ビタミンの補給源,細胞膜の構成成分,生理活性物質としてなど,多様な栄養生理機能をもっている.
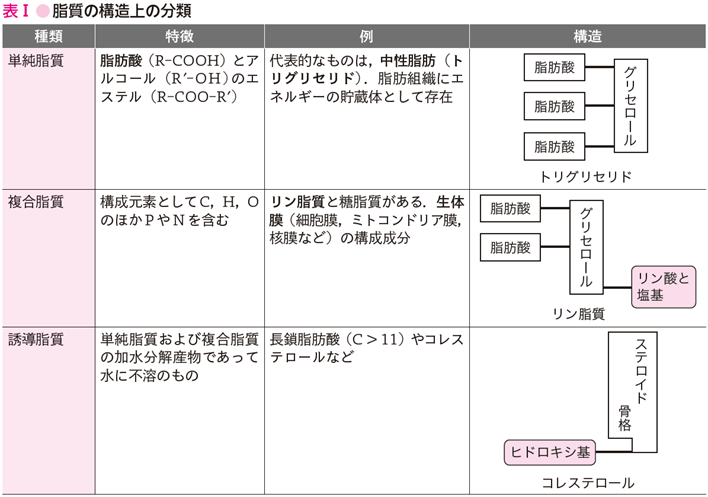
脂質とは,ベンゼン,エーテル,クロロホルムなどの有機溶媒には可溶であるが,水には不溶または難溶性を示す物質の総称である.これは脂質が極性をもたない長い鎖状あるいは環状の炭水化物によって構成されているためにみられる性質で,極性分子の溶媒である水とはなじみにくく,疎水性を示す.脂質を化学構造から大別すると,単純脂質(simple lipid),複合脂質(complex lipid),および 誘導脂質(derived lipid)に分類できる(表Ⅰ).これら脂質の基本的な構成要素は,脂肪酸である.
■脂質の消化と吸収
食事中の脂肪酸は,主にトリグリセリド(トリアシルグリセロール)の形で存在する.食事中のトリグリセリドは,十二指腸において胆汁の胆汁酸塩とエマルジョンを形成した後,
膵液から分泌される膵液リパーゼにより,脂肪酸とグリセロール(主にモノアシルグリセロールやグリセロール)に分解される.これらはミセルとなって,小腸粘膜細胞から吸収される(図Ⅰ).脂肪酸のうち,短鎖脂肪酸,中鎖脂肪酸は小腸の毛細血管から吸収され門脈経由で肝臓に輸送される.一方,長鎖脂肪酸とモノアシルグリセロールは,再びトリグリセリドを形成しリポタンパクであるカイロミクロンに取り込まれる.カイロミクロンは,小腸のリンパ管に取り込まれ,胸管を経て全身の大循環に合流し最終的には肝臓に到達する.
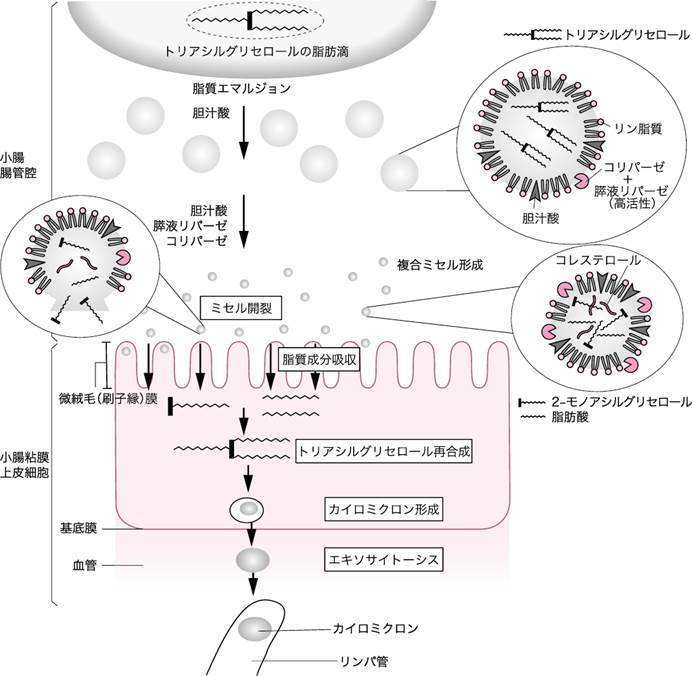
図Ⅰ●トリグリセリドの消化と吸収
(文献2-4-1より引用)
■トリグリセリドおよび脂肪酸の代謝
エネルギーの貯蔵,供給に関する脂質の代謝は,炭素数2の化合物であるアセチルCoAが重要な中間代謝産物で,これから脂肪酸,ケトン体,コレステロールが合成される(図Ⅱ).生体内の代謝として,食後やエネルギー余剰の際,脂質はアセチルCoAから脂肪酸に変換され,さらにトリグリセリドが合成されて貯蓄される.脂肪酸の合成経路は,肝臓,腎臓,脂肪組織,脳などの組織に存在し,合成に必要な一連の酵素は,細胞質ゾル(cytosol)にある.まず脂肪酸(パルミチン酸)の合成が行われる.肝臓をはじめさまざまな組織で,脂肪酸およびグリセロール 3-リン酸を材料としてトリグリセリドが合成される.なお,グリセロール 3-リン酸の供給源は,解糖系で生じたジヒドロキシアセトンリン酸および遊離のグリセロールである.トリグリセリドは余剰のエネルギー源であり,その貯蔵量は体タンパク質と同程度の体重の約20%程度であり,優に1カ月分を超えるエネルギーの備蓄となっている.
トリグリセリドは,ヒトの脂肪組織に貯蔵され,細胞内で必要に応じて分解されて脂肪酸とグリセロールになる.グリセロールは解糖系に入って代謝されてATPを産生するほか,糖新生によってグルコースに変換される.一方脂肪酸は,ミトコンドリアでβ酸化を受けてアセチルCoAに転換された後,クエン酸回路に入ってATPを効率的に産生する.
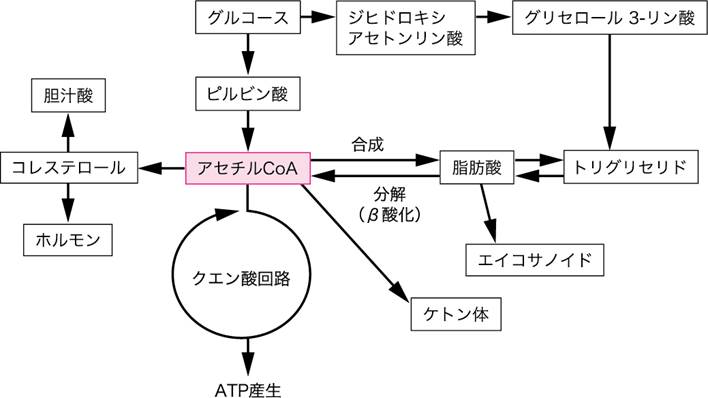
図Ⅱ●アセチルCoAを中心とした脂質代謝の概要
関連キーワード
· [2] 必須脂肪酸[essential fatty acid]
· [10] ステロイドホルモン[steroid hormone]
電解質
■電解質とは
電解質は,溶液中でカチオン(+荷電)とアニオン(-荷電)に解離する物質であり,Na+,K+,Ca2+,Mg+,Cl-などの無機塩やHCO32-,HPO42-,SO42-などの有機分子がある.
細胞内液,組織間液,血漿においてカチオン,アニオンそれぞれの総和は等しく維持され,1ミリ当量(1 mEq)の物質は,反対の荷電をもつ物質1 mEqと化学結合する.水分出納と分布,浸透圧平衡,酸塩基平衡,細胞内外の濃度差などの重要な生理機能に関与している.
ここでは,通常,体液管理を行う場合に重要となる,ナトリウム(Na),カリウム(K),クロール(塩素:Cl),カルシウム(Ca),マグネシウム(Mg),リン(P)をとり上げる.
関連キーワード
微量元素
■微量元素とは
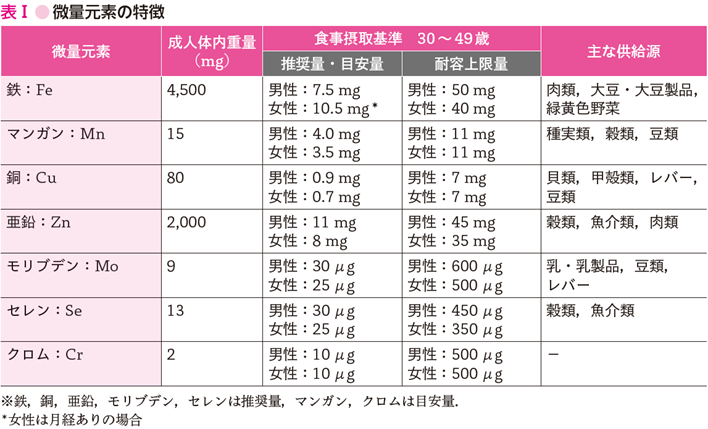
微量元素は,成人体内量で10 g未満,1日の必要量が100 mg以上の無機質(ミネラル)であり,鉄(Fe),亜鉛(Zn),銅(Cu),セレン(Se),クロム(Cr)マンガン(Mn),モリブデン(Mo),コバルト(Co),ヨウ素(I)の9種類が該当する.ここでは,赤字で示した7種類について述べる.
関連キーワード
· [8] 慢性疾患貧血(ACD)[anemia of chronic disease]
ビタミン
■ビタミンとは
ビタミンは,生体内代謝において必須であるにもかかわらず,その生理的必要量を生体内で合成できない有機化合物または有機化合物群であり,その代謝機能は膜の安定剤,水素(H+),電子(e-)の供与・受容体,ホルモン,補酵素の4つに分類することができる.
ビタミンは,水溶性ビタミンと脂溶性ビタミンに分類される.水溶性ビタミンは排泄されやすく,体内蓄積量が少ないため欠乏症を生じやすいが,過剰症は少ない.一方,脂溶性ビタミンは,多量に投与されると過剰症を引き起こしやすく,脂肪消化・吸収障害時には欠乏症が生じる.
関連キーワード
· [1] ビタミンB1[vitamin B1, thiamine]
· [2] ビタミンB2[vitamin B2, riboflavin]
· [3] ビタミンB6[vitamin B6, pyridoxine]
· [4] ビタミンB12[vitamin B12 cobalamin]
· [5] ビタミンC[vitamin C, ascorbic acid]
· [6] ナイアシン[niacin, nicotinamide]
· [7] パントテン酸[pantothenic acid]
· [10] ビタミンA[vitamin A, retinol]
· [11] ビタミンD[vitamin D, carciferol]
· [12] ビタミンE[vitamin E, tocopherol]
· [13] ビタミンK[vitamin K, phylloquinone]
食物繊維
■食物繊維とは
食物繊維に関する統一した定義はなく,さまざまなものがあるが(表Ⅰ),基本的には消化管で消化されない多糖類であること,または生理機能を有する難消化性の炭水化物を指しており,日本食物繊維学会は,これら消化抵抗性の食品成分を包括的に合わせて,ルミナコイド(luminacoid)という用語を提唱している.分類も,食物繊維の由来をもとにして水溶性食物繊維(soluble dietary fiber)と不溶性食物繊維(insoluble dietary fiber)に分ける方法(表Ⅱ)や,ホモグルカン,ヘテログルカンなど化学構造をもとにして分ける方法などがある.また,日本で食品表示に用いられる食物繊維には,表Ⅲに示したものがある.



(文献2-8-1より引用)
日本人の食事摂取基準(2020年版)による食物繊維の目標量は,1日20 g程度であるが,2017年の国民健康・栄養調査結果では,14~15 g/日を推移している.
関連キーワード
· [1] 水溶性食物繊維[soluble dietary fiber]
· [2] 不溶性食物繊維[insoluble dietary fiber]
· [5] 腸内細菌叢[intestinal bacterial flora]
· [6] GLP-1[glucagon-like peptide-1]
· [7] 短鎖脂肪酸[short-chain fatty acid:SCFA]
古典的な生体反応の推移の分類
■はじめに
手術などの侵襲に対する生体反応の仕組みの解明は,近年の分子生物学の進歩によって目覚ましい発展を遂げた.その陰には,今日までに積み重ねられてきた数多くの研究の成果がある.その多くは生体反応の細部を深く探求するものであった.一方ではこれらの研究成果を体系化し,生体反応の仕組みを個体のレベルで解明して,それを診療に結びつけようとする試みもなされてきた.近代医学におけるその成果の代表は Francis D. Moore による学説(参考文献3-1-1)であろう.
彼は患者の術後経過を病像の移り変わりによって4つの相(病期)に区分し,それぞれの病期における生体反応の仕組みや特徴を,生理機能や検体検査の値を測定することによって説明した.その分析に分子生物学的手法が使われていないことから,この学説は古典というべきであろうが,今なお輝きを失わぬ不朽の名著である.ここでは,Moore の学説について解説する.
彼はまず術後の病期を4相に分け,それぞれの相における臨床像,創傷治癒,内分泌,代謝と生化学などに関する特徴を理論的に解明し,これに基づいた適正な治療法についても言及した.
■第1相(Injury Phase)
この相は術後の2ないし4日間で,傷害期(adrenergic-corticoid phase)ともいわれる.
A. 臨床像
大手術後の麻酔から覚醒した患者は傾眠状態で,周囲に無関心である.心拍はやや頻脈であるが,失血が補充されていれば数時間以内に落ち着き,翌日には正常化する.体温は1℃以上上昇する.腸管運動は12~24時間後に減弱し,腸音はその後1~2日間は聴取不能になる.
B. 創の状態
術後の数日間は創の引っ張り強度が弱い.縫合不全の原因として,異常な外力,縫合糸の選択誤り,不良縫合,不良結紮があげられる.またステロイドも創傷治癒を遅延させる.
局所では,白血球や免疫タンパクが細菌汚染と毒性を低減する.また細胞外液中のタンパク質,ムコ多糖類,アミノ酸,ビタミンCが集積し,後にコラーゲンが生成される.
なお,患者が飢餓や筋タンパク異化の状態にあっても創傷治癒機転は働く.
C. 内分泌系の変化
① 副腎髄質
精神的ストレス,あるいは低酸素,出血,ショックなどのストレスにより交感神経-副腎系が刺激され,アドレナリン(エピネフリン),ノルアドレナリン(ノルエピネフリン)が分泌される.患者は頻脈になり,血管が収縮し,交感神経性の発汗が出現する.1~2POD(術後日)はアドレナリンとノルアドレナリンの尿中排泄が増加する.
② 副腎皮質
侵襲が起こると神経・体液の求心性経路が第三脳室床,続いて下垂体前葉を刺激し副腎皮質刺激ホルモン(adrenocorticotropic hormone:ACTH)を分泌させる(神経内分泌相関).
ⅰ)ハイドロコーチゾン
侵襲後,ACTHの刺激により副腎皮質からハイドロコーチゾンが分泌される.そのピークは麻酔後6時間から術後2~4時間くらいの間で,翌朝には元に戻る.
尿中総17-OHCS(17-hydroxycorticosteroid)は3~4倍に達する.
ⅱ)好酸球
副腎皮質ステロイドの増減と好酸球の増減は逆相関する.手術室到着時に患者の好酸球は25~30%減少する.そして麻酔導入後に400~500 /mm3に増加する.その後2~4PODまで著しく減少する.3~7PODには尿中17-OHCSは減少し,好酸球が増加する.異化期から同化期への重要な過程である.6PODでの好酸球減少は合併症(敗血症,静脈炎,腎不全,無気肺)の存在を意味する.
ⅲ)アルドステロン
外傷後や低Na血症時にアルドステロンの分泌が増加する.
③ その他
性腺機能は傷害後低下する.傷害後のVO2(酸素消費量)とVCO2(二酸化炭素産生量)の増加には甲状腺ホルモンも少ないながら関与している.膵臓に関しては,膵内分泌相関の変化が起こる.血糖上昇はハイドロコーチゾンやインスリン拮抗物質の増加によるところが大きい.副甲状腺機能は傷害後に変化せずCa,P値に変動はない.
D. 代謝と生化学
① 窒素
尿中窒素(N)排泄は術後増加する.2~5PODの尿中N排泄量は通常手術で7~15 g/日,大侵襲手術では20~30 g/日に及ぶ.
タンパク異化は副腎ホルモンの変化によって起こる.通常の手術によるこの相の総喪失量はN50 g,タンパク質312 g,筋肉湿重量1,500 g(水1 L)程度である.その後尿中N排泄の増加と負のNバランスは急速に終息してゆき,ターニングポイントを迎える.
② カリウム
骨格筋タンパクの崩壊に伴って尿中カリウム(K)排泄が増加する.K排泄量は1PODは70~90 mEq/日に達するが,2PODは少し減少し,3~6PODには正のバランスに達する.第1相のK排泄総量は240 mEqに及ぶ.血漿K値は4.8~5.0 mEq/Lに上昇する.
③ ナトリウム
尿中ナトリウム(Na)排泄は減少する.大手術後では100
mEq/日から1 mEq/日程度に著減し,これが数日から数週続く.Naの喪失は通常100 mEq/日程度である.血漿NaはNaの移動と希釈により130~135 mEq/Lに低下する.血漿浸透圧も270 mOsm/L程度に低下する.この希釈はNa-free水2 L投与に匹敵する.
④ エネルギー源
術後の絶食期には内因性のエネルギー基質が利用される.内因性の糖質(肝,筋グリコーゲン,細胞外液中グルコース)は300~500 gにすぎず,短時間で消費される.筋タンパクの分解によって生じたアミノ酸から糖新生が行われる.尿中N排泄量が20 gの場合,125 gのグルコースが生じる.体脂肪の動員は重症例では250~500 g/日(2,000~4,500 kcal/日)に及ぶ.術後5日間の体重減少が3 kg程度の場合,体脂肪の減少は約1.5 kgである.
⑤ 水分代謝
体脂肪1 kgの酸化により1,000 mLの水が生じる.骨格筋1 kgの分解によって730 mLの水と,そのタンパク質の酸化により250 mLの水が生まれる.水の喪失については,不感蒸泄は呼気中排泄,発汗ともに増加し,尿量は減少する.尿量は通常450~1,000 mL/0 POD,1~2日で軽度の利尿に向かう.5日間の水喪失は不感蒸泄4 Lと尿3.5 L程度である.
細胞内液と脂肪を犠牲に細胞外液量は増加する.熱傷,挫滅,腹膜炎などでは機能的細胞外液量が減少する.
E. 臨床管理法
① 手術手技
よい手術は第1相の終了を早め,消化吸収を回復させ,患者を早期離床,早期同化に導く.正確で,無菌的,愛護的な手術が最善の代謝管理でもある.
外傷では,手術に至るまでの出血,ショック,低酸素,感染の有無が生存に影響する.
② 容量維持
失血に対し術中から逐次均等に補充する.しかし出血量が500 mL以下では輸血はしない.
③ 術後管理
ⅰ)輸液
300~500 mLの飲水ができれば輸液は不要である.腎臓は水と細胞外液の塩を保持する.消化器手術では,発熱,呼吸困難,腎外喪失がなければ750~1,500 mLの輸液で足りる.輸液剤は5%ブドウ糖液と生理食塩液の混合でよい.ビタミンは栄養良好例では不要である.高齢者,腎・心疾患合併例では正のNaバランスは有害である.
ⅱ)摂食
腸蠕動が聴取され,ガスが排出されたら経口食を開始する.過剰な摂食は嘔吐と誤嚥,腹部膨満と創哆開の原因になる.カロリーを投与することより腹部を平坦にしておくことの方が大切である.
ⅲ)細菌のコントロール
無菌手術が前提となるが,抗菌薬の予防投与は有害である.汚染創や解剖学的に細菌が生息する部位の手術の場合は抗菌薬を投与する.
ⅳ)その他の管理
早期離床は無気肺,創哆開,血栓性静脈炎などの合併症の頻度を低減する.合併症のない患者の頻回の血液化学検査は不要,不経済である.
■第2相(Turning Point)
第2相はcorticoid-withdrawal
phaseと同じものである.通常3~7PODにはじまり,1~2日間続く.感染が持続している例などではその発現が遅れる.
A. 臨床像
臨床像は急展開をみせる.疼痛は軽減し,解熱する.体動,腸蠕動が活発になリ,周囲への関心もでる.
B. 創の状態
引っ張り強度は化学的,形態学的に増強する.線維組織にコラーゲンが増量する.軟部組織の清潔創ではNバランスが正転する前に創傷治癒が起こる(4~8POD).創傷治癒には内因性基質が利用される.縫合不全はむしろ例外である.飢餓での縫合不全はビタミンC欠乏,感染,浮腫による.単なる摂取カロリー量の不足は縫合不全の原因にならない.
C. 内分泌系の変化
副腎髄質系症状(頻脈,蒼白,発汗)はすでに消失しており,副腎皮質ホルモンの指標がこの時期に正常化する.17-OHCSは低下し,好酸球数が回復する.尿中N排泄量の減少,Na排泄量の増加がみられる.敗血症などの合併症があると副腎皮質ホルモン優位の状態が持続する.
D. 代謝と生化学
第1相では15~20 g/日であった尿中N排泄量が5~7 g/日にまで急速に減少する.一方,100 g/日位の内因性脂肪の酸化は持続し,エネルギー900 kcal/日と水920 mL/日が生成される.
第1相では内因性脂肪の酸化とタンパク異化が一方的であったのに対し,第2相では適切なエネルギー投与でタンパク合成がはじまる.栄養摂取は20 kcal/kg体重/日,0.1
gN/kg体重/日(NPC/N=200)ではじめる.その後5日間は2倍投与する.
血漿Naは増加,Kは低下,細胞内Kは増加するなど,すべてが正常化に向かう.
E. 臨床管理法
消化管が正常なら摂食ができ,食欲もでる.正のNバランスを取り戻すことが筋力を獲得するうえで不可欠である.摂食しなくても創は治癒するが,患者は元気にならない.
■第3相(Muscle Strength)
第3相は第2相の1~2日後から2~5週間で,正のNバランス,筋組織の再合成,筋力の回復が得られる.
A. 臨床像
退院が可能になる.食欲が回復し,便通も正常化する.
B. 創の状態
創は赤色瘢痕化し,引っ張り強度は完成する.
C. 内分泌系の変化
ステロイド系ホルモンはこの時期には正常化している.
D. 代謝と生化学
タンパク合成は一定の速度に達し,体重70 kgの患者ではNバランスは+3~4 g/日,骨格筋増加は90~120 g/日になる.これは全筋肉量の0.2~0.5%に相当する.
E. 臨床管理法
回復期の同化を遂行するには摂取エネルギー以上の仕事をしてはいけない.アナボリックステロイドが正常な同化状態の患者に有効であるというエビデンスはない.ただし食欲を増進させるものは有効である.
■第4相(Fat Gain)
第4相は脂肪による体重増加の時期で,数カ月続く.
A. 臨床像
患者の見た目は病み上がりである.Nバランスは±0,炭素(C)やエネルギーのバランスは正である.
B. 創の状態
創は白色瘢痕になる.
C. 内分泌系の変化
内分泌バランスに変化はなく,月経が回復する.
D. 代謝と生化学
体脂肪量の回復が起こる.その量は75~150 g/日で,脂肪喪失量が5 kgの場合は回復に1カ月以上を要する.
E. 臨床管理法
理想体重に戻るまでは正のエネルギーバランスを要する.肥満を避けるにはエクササイズが必要である.
関連キーワード
· [3] 神経内分泌相関[neuroendocrine mediation]
· [4] タンパク異化[protein catabolism]
侵襲に対するサイトカインと内分泌反応
■はじめに
侵襲が生体に加わると末梢や中枢の受容体で感知され,視床へ送られた情報に応じて,神経・内分泌系が内部環境維持のための生体反応を引き起こす.以前から,これらの系に加えてエイコサノイドやセロトニンなどのメディエーターが,侵襲時の生体反応調節に関与していることが判明していたが,近年,サイトカインの研究が飛躍的に進み,侵襲時の生体反応の主役として認識されるようになった.実際,TNF-αやIL-1などの炎症性サイトカインを投与すると,敗血症時と同様のショックや臓器障害が誘導される.一方,サイトカイン分泌にかかわる免疫系と神経・内分泌系のクロストークについても明らかになりつつある.特に,迷走神経刺激による炎症性サイトカイン産生抑制が明らかになり,炎症制御・臓器障害予防のための新たな治療法開発の手掛かりとして注目されている.本節では,侵襲に対する生体反応におけるサイトカインの役割を中心に概説する.
■侵襲に対する生体反応
生体は侵襲に対して組織の機能を保ち,病原体の侵入を防ぐために,神経系・内分泌系・免疫系のさまざまな反応を引き起こす.組織損傷と病原体による汚染は,直接,免疫細胞を活性化してサイトカインなどのメディエーター放出を高める(図ⅠA).リポポリサッカライド(lipopolysaccharide:LPS)をはじめとする病原体関連分子パターン(pathogen-associated molecular patterns:PAMPs)が,免疫細胞表面の受容体により認識され,細胞の活性化を高めサイトカイン産生を高めることが知られている.また,侵襲刺激は,各種受容体を介して視床下部に伝達され,交感神経系─副腎髄質系を中心とした自律神経系の反応と下垂体─副腎皮質系を中心とした内分泌系の反応を引き起こす.免疫細胞表面のホルモン受容体,ニューロペプチド受容体にこれらの反応により分泌されたホルモンやニューロペプチドが結合すると,免疫細胞の機能が修飾される(図ⅠB)(参考文献3-2-1).このように,サイトカインを中心とした免疫系は,侵襲に対して独自に反応するとともに,神経・内分泌系とクロストークしている.
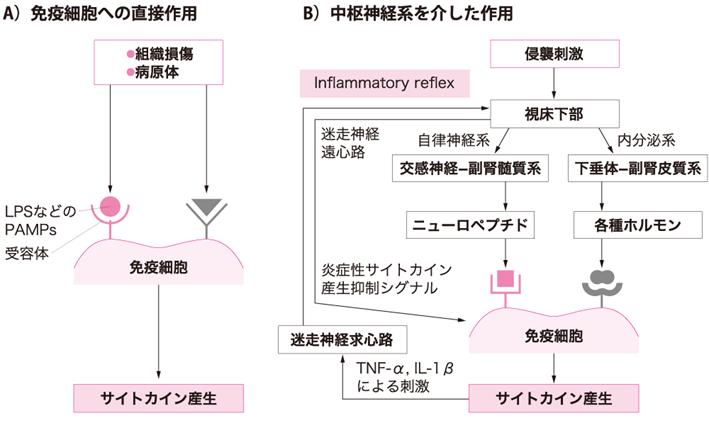
図Ⅰ●侵襲に対するサイトカインの産生

侵襲が限局した組織を傷害し,その持続期間が短い場合には,適度な生体反応によって傷害部位が治癒し,病原体が排除される.しかし,過大な侵襲は,全身性の激しい炎症反応を引き起こし,多臓器不全を惹起し生存をおびやかす危険性がある.このような病態は,しばしばSepsisとして認識され,治療法開発のために数多くの臨床試験が行われてきた.しかし,一定の成果を得るに至らず,Sepsisの定義のあいまいさが問題となった.そのため,1991年の米国胸部疾患学会と集中治療医学会の合同カンファレンスでSIRS (systemic inflammatory response syndrome)の概念が提唱された.SIRSは,その原因となった侵襲の種類によらず表Ⅰに示す診断基準を満たす病態すべてを含み,感染症が存在するSIRSをSepsisと呼ぶようになった(参考文献3-2-1).
■侵襲時の生体反応を引き起こす液性因子
ホルモンとサイトカインは,ともに微量で強力な生理活性をもつ液性因子である.侵襲時には,これらの液性因子の産生パターンが変化し,さまざまな生体反応を引き起こす.ホルモンが特定の臓器で産生され特定の標的臓器をもつペプチドであるのに対して,サイトカインは複数の臓器(白血球や血管内皮細胞,線維芽細胞など)で産生され,通常はパラクラインあるいはオートクラインに働くタンパク質であり,多彩な作用をもち,異なるサイトカインが重複した作用をしばしば示す.
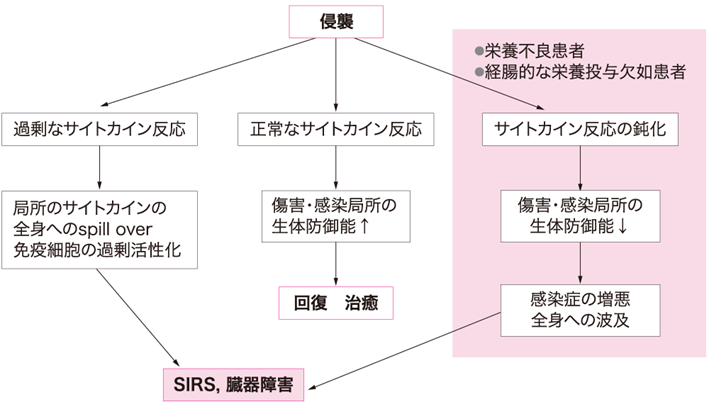
図Ⅱ●栄養不良・経腸的栄養投与欠如時のサイトカイン反応低下
そのため,過剰なサイトカインの産生は,全身の非常に強い炎症反応を引き起こす.実際,SIRSの病態が,サイトカインの投与によって再現されることから,SIRSは高サイトカイン血症と認識されるようになった.
■侵襲時のサイトカイン反応
サイトカインは傷害部位・感染部位の局所で適度に産生され作用する限りは,組織修復・病原体排除に必要不可欠である.しかし,局所で過剰に産生されたサイトカインは,全身にあふれだしSIRSの原因となる.一方で,栄養制限や経腸的な栄養投与欠如時にみられる感染局所におけるサイトカイン反応の低下は,局所の感染防御能を著しく低下させ,感染の全身への波及を招くことがわれわれの動物実験でも明らかになっている(図Ⅱ)(参考文献3-2-2)~(参考文献3-2-4).つまり局所でのサイトカイン反応の低下によって全身に波及した感染が原因となって全身性の高サイトカイン血症が生じると,SIRSを引き起こす危険性がある(参考文献3-2-3).
サイトカインには,炎症反応を高める炎症性サイトカインに加え,過剰な炎症反応を制御する抗炎症性サイトカインが存在する.両者が適度なバランスをとって産生・分泌されるなかで,炎症反応は終息に向かう.炎症性サイトカインの働きが非常に強く,抗炎症性サイトカインの働きが弱いと,SIRSによる臓器障害が惹起されるし,抗炎症性サイトカインの働きが相対的に強くなると免疫能低下から重症感染症を合併するおそれがある.炎症反応の終息には,抗炎症性サイトカインの産生,炎症性サイトカインの局所からの消失に加え,レゾルビン・プロテクチン・リポキシンなどの脂質メディエーターも重要な役割を果たしている.
■侵襲時の内分泌反応
侵襲が加わると視床下部に刺激が伝達され,神経・内分泌系反応によってストレスホルモン(8-1:ストレスホルモン[stress hormone]https://www.nutri.co.jp/nutrition/keywords/ch8-1/keyword6/)の分泌が増加し,代謝の亢進・糖新生の増加と耐糖能低下・脂肪分解亢進と遊離脂肪酸の増加・異化の亢進(タンパク分解亢進)が招来される.これらの代謝の変化は,糖をエネルギー基質とする中枢神経系の細胞や白血球に十分なエネルギーを供給し,創傷治癒や感染防御能を高めるうえで好都合である.また,筋や脂肪組織などの末梢組織におけるインスリン抵抗性の増加は,糖を必要とする部位への優先的な糖供給を可能にする.
■迷走神経によるサイトカイン反応の調節
近年,炎症反応の調節に迷走神経が大きな役割を果たしていることが判明した(参考文献3-2-5).炎症性サイトカイン刺激は迷走神経の求心性線維を介し中枢の孤束核に伝わる.背側運動核から発した迷走神経の遠心性線維は,マクロファージのα7受容体を刺激し炎症性サイトカイン産生に負のフィードバックをかける(図ⅠB)(参考文献3-2-6).この調節経路を“inflammatory reflex”といい,過剰な炎症を制御し,ホメオスターシスを維持している.
迷走神経による炎症反応調節を利用して,さまざまな侵襲に対する生体反応を改善する試みが行われている(参考文献3-2-6).電気刺激による迷走神経刺激は,ラット炎症性腸疾患モデルで組織の炎症像改善・体重減少緩和効果を示した(参考文献3-2-7).α7受容体のアゴニストとしてニコチンを投与することで,敗血症モデルの血中TNF-α,IL-1β,IL-6,HMGB-1などの低下や生存の改善が観察されている(参考文献3-2-8),(参考文献3-2-9).しかし,その一方で,外傷性脳損傷時には迷走神経刺激が持続的に亢進することで抗炎症性反応が優位となり感染に対する防御能が低下する危険性がある(参考文献3-2-10).
■おわりに
侵襲に対する生体反応は,神経・内分泌系,免疫系が複雑に関連し,互いのフィードバックによって調節されている.生体が侵襲を生き延びるためには,適度な生体反応が必須であるが,この複雑なネットワークの解明なくしては生体反応の調節もおぼつかない.今後のさらなる基礎的・臨床的な研究がのぞまれる.
関連キーワード
· [1] TNF-α[tumor necrosis factor-α]
· [4] 炎症性サイトカイン[inflammatory cytokine]
· [7] HMGB-1[high mobility group box-1]
· [8] レゾルビン・プロテクチン・リポキシン[resolvin, protectin, lipoxin]
· [10] アドレナリン・ノルアドレナリン[adrenaline,noradrenaline]
飢餓と侵襲に対する生体反応の違い
■はじめに
生体に侵襲が加わると,生体は内部環境を維持し損傷を修復しつつ感染防御能を高めるためにさまざまな反応を引き起こす.これらの反応は生体が侵襲を克服しその生命を維持するために必要不可欠なものである.一方,生体にとって飢餓は,古くから最も生命をおびやかす現象の1つであり続けたし,医学の進んだ今日でも驚くほど多くの低栄養患者が存在している事実から現在でも大きな問題であることに変わりはない.生体は侵襲同様,飢餓に対しても適応し生命を維持するための生体反応を引き起こす.飢餓と侵襲は,患者が遭遇する代表的な病態であるが,それぞれに対する生体反応は大きく異なっている.本節では,それぞれの病態における代謝の変化を述べるとともに,飢餓状態に侵襲が加わった場合の生体反応について最近のわれわれの知見を中心に説明する.さらに,本来の飢餓ではないが,中心静脈栄養管理時など消化管内腔に直接栄養が供給されない状況(消化管の飢餓状態)で生じる生体反応の変化についても説明を加える.
■飢餓時の代謝の変化
飢餓時には生体のエネルギー需要を充足するだけの十分な栄養が外部から補給されない.そのため生体は体内に貯蔵されているグリコーゲンや筋タンパク,脂肪を動員して不足分を補う.しかし,飢餓が長期間に及べば臓器のエネルギー利用パターンを変化させ,外部への窒素放出を極力抑え体タンパクの維持を図る.
A. 短期飢餓時
5日以内の短期間の飢餓時には,生体は筋タンパクと体脂肪をエネルギー需要(25 kcal/kgの基礎代謝量)を満たすために使用する.グルカゴンやノルアドレナリン,バソプレシン,アンジオテンシンⅡの働きによって体内のグリコーゲンが分解されグルコースが供給される.グリコーゲンの貯蔵量は成人で300~400 gに及ぶが,その70%は筋組織に蓄積されており全身へのグルコース供給源としては機能しない.したがって,全身へのグルコース供給は肝グリコーゲンによってまかなわれるが,貯蔵量は少なくわずか十数時間内に枯渇してしまう.そこで,骨格筋や赤血球・白血球における解糖で生じた乳酸やピルビン酸から,肝で糖が新生される.しかし,この系(コリ回路)による糖新生では全身の糖需要を満たすことができないため,筋肉を中心とした体タンパクの分解によって生じたアラニンが糖新生に利用される(図Ⅰ)(参考文献3-3-1).
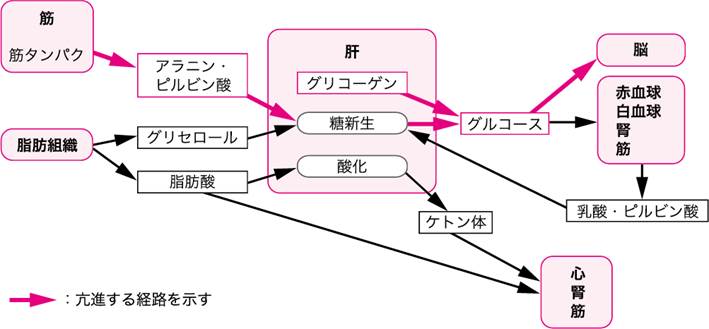
図Ⅰ●飢餓初期の代謝の変化
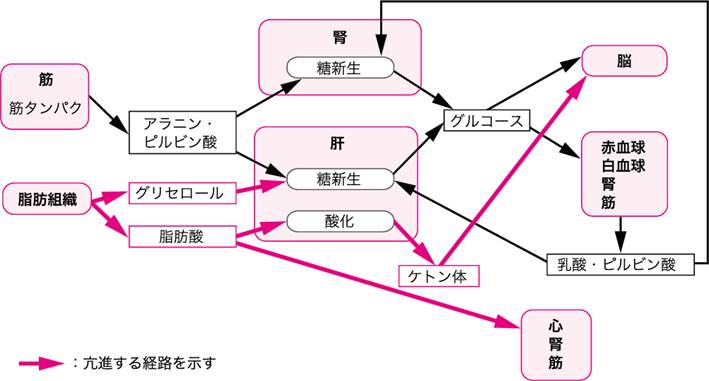
図Ⅱ●飢餓後期の代謝の変化
B. 長期飢餓時
飢餓が長期に及ぶ場合は,体タンパクの崩壊・尿中への窒素分泌が減少し,体タンパクの維持・臓器機能の維持を図る.これは,脳や心筋,骨格筋などの重要臓器がエネルギー基質として脂肪を消費するように適応することによる.インスリンレベルの低下とグルカゴン,カテコールアミンの上昇は,脂肪組織中からの遊離脂肪酸の放出を高め,遊離脂肪酸とケトン体がエネルギー源として利用される.長期の飢餓時には肝に加え腎も糖新生の主要臓器となり,グルタミンやグルタミン酸を糖に変換する(図Ⅱ).
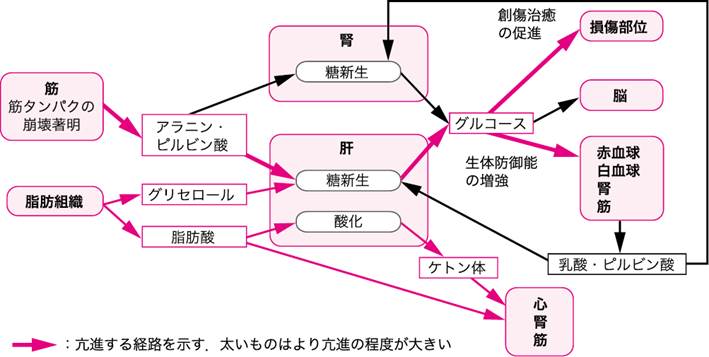
図Ⅲ●侵襲時の代謝の変化
■侵襲時の代謝の変化
侵襲後早期には体液量減少性ショックを呈し,血行動態が不安定になる.この時期には生命維持が優先され,心拍出量・酸素消費量・代謝率が減少する.しかし,その後は,グルココルチコイド(糖質コルチコイド)・グルカゴン・カテコールアミンの分泌が高まり代謝が亢進し,侵襲に伴う組織損傷の修復,外部からの病原体の侵入を防ぐために免疫系を活性化させる.脂肪組織からはグリセロール・脂肪酸が,肝臓からはグリコーゲンが分解されグルコースが,筋組織からはアミノ酸が放出され,エネルギー源として使用される.脂肪酸はそのままあるいは肝でケトン体に変換されて心・腎・筋のエネルギー源として使用される.筋から放出されたアミノ酸と脂肪組織から放出されるグリセロールは肝・腎における糖新生に利用され,産生されたグルコースは創傷部位や血球・神経系・腎・筋で使用される(図Ⅲ)(参考文献3-3-1).
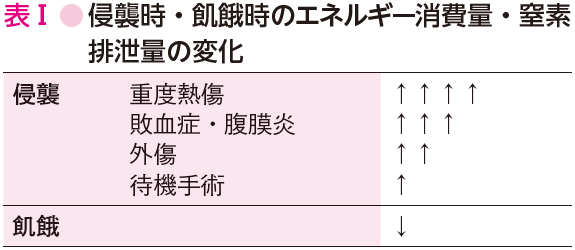
飢餓時の代謝の変化との相違は,飢餓時には代謝が低下し窒素排泄を抑え体タンパク維持に向かうのに対し,侵襲時には侵襲の大きさに応じて代謝が亢進することである(表Ⅰ)(参考文献3-3-2).したがって,侵襲時には外部からの栄養補給が十分に行われないと,急速な体タンパクの喪失・体重減少が生じてしまう.
■飢餓時に侵襲が加わった場合の生体反応
前述したように飢餓と侵襲では生体の代謝の変化が異なる.しかし,飢餓状態の生体に強い侵襲が加わる,あるいは強い侵襲が加わった結果,栄養摂取が不十分となり飢餓状態に陥るという病態は,外科領域・救急集中治療領域でしばしば経験される.飢餓によって侵襲時の生体反応がどのように修飾されるか基礎研究のデータを中心に述べる.
A. 感染性侵襲
以前から飢餓,栄養不良患者では,感染性合併症の発生が多く,創傷治癒が遅延し,その結果,入院期間が延長し医療費の増加を招くことが知られていた.その機序の一端を明らかにするため,飢餓状態のモデルとしてマウスの栄養摂取量制限モデルを作製し,腹腔内細菌汚染時の腹腔内白血球を中心とした感染防御機構の変化を検討した.
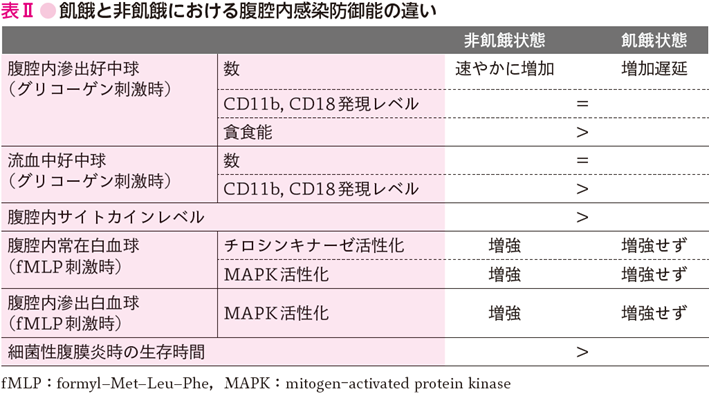
マウスに自由経口食餌摂取,あるいはその半分もしくは4分の1の食餌を与え1週間管理した後,化学的腹膜炎を惹起するため腹腔内にグリコーゲンを投与すると,自由摂取群では,早期の腹腔内滲出好中球数増加が認められたが,栄養制限群ではいずれもその増加が遅れて生じた.また,流血中の好中球のCD11b, CD18発現レベルが栄養制限群で低下した.腹腔内のTNF-α(tumor necrosis factor-α),IL-6,MIP-2(macrophage inflammatory protein-2)レベルはいずれも自由摂取群では早期に上昇したが,栄養制限群ではわずかな上昇にとどまった(参考文献3-3-3).同モデルで腹腔内常在白血球・滲出白血球を採取してin vitroでfMLP(formyl-Met-Leu-Phe)刺激下に培養すると,通常量食餌摂取群では細胞内チロシンキナーゼの活性化が高まるが栄養制限群では活性化増強は認められなかった(参考文献3-3-4).同様の現象は細胞内MAPキナーゼ(mitogen-activated protein kinase:MAPK)であるERK(extracellular signal-regulated kinase)の活性化でも観察された(参考文献3-3-5).これら,細胞内シグナル伝達活性化・流血中および腹腔内白血球活性化・腹腔内サイトカイン反応の低下に関連して,栄養制限群では盲腸結紮穿刺による腹膜炎作製時の生存が自由摂取群に比べて悪化した(表Ⅱ).
これらの結果は,飢餓時,栄養不足時には,本来腹腔内汚染時に活性化する生体防御系が鈍化してしまうことを示唆している.われわれは,同様のモデルで,腸管免疫の変化や肝免疫の変化について検討を行っている.栄養制限時には粘膜免疫の誘導器官であるパイエル板のリンパ球数の減少がみられるし,肝単核球の減少と機能低下が観察されている.すなわち,飢餓時には,① 代謝の点では適応し体タンパク維持に向かうが感染防御能は低下している,② 飢餓時に感染性侵襲が加わると通常みられる免疫系の活性化が鈍化・遅延するため予後不良となる,といえよう.

B. 非感染性侵襲
近年,侵襲時の生体反応に関する研究が進み,侵襲に伴って生じる組織傷害・臓器不全の原因として宿主自体の免疫系細胞の過剰活性化が重要であることが判明した.特に,過剰に活性化した好中球は,大量のフリーラジカルを産生しタンパク分解酵素を放出するため臓器障害の主体として認識されている.前述したように栄養不良時に免疫担当細胞の侵襲に対する活性化が鈍化するのであれば,非感染性侵襲時にはそれらの細胞による臓器障害が軽減し,結果として予後が改善する可能性もある.
そこで,われわれは,ショック・外傷・大手術後の臓器不全のメカニズムとして注目されている腸管虚血再灌流のマウスモデルを用いて,侵襲前の栄養制限(飢餓)が生体反応に及ぼす影響を検討した.マウスを自由摂食あるいはその70%,40%の食餌で1週間管理後,上腸間膜動脈を15分間クランプ,その後クランプ解除し,腸管虚血再灌流を加えた.その結果,予期したように流血中の好中球・単球の活性化は食餌制限群で自由摂食群に比べ,CD11b発現・活性酸素の産生・核内転写因子NF-κB(nuclear factor-κB)の核内への移動などの点から低下していた.しかし,同時に小腸の抗酸化物質であるグルタチオンのレベルが食餌制限群で低下しており,肺・肝・小腸の臓器障害の程度は病理学的に増悪,生存も悪化した(表Ⅲ)(参考文献3-3-6).
これらの結果から,非感染性の侵襲時にも飢餓状態にある生体は抵抗性が低下すると考えられる.組織の攻撃因子の減弱にもかかわらず抵抗性が低下することから,その機序としては,防御因子の減弱が重要と推察される.
■消化管の飢餓状態によって生じる生体反応の異常
飢餓が感染性侵襲・非感染性侵襲のいずれに対しても,生体防御能の低下を招き,予後を増悪させることを前述した.中心静脈栄養管理(TPN)は,進行性の栄養不良を防ぐことが可能であるが,消化管内腔への栄養投与が欠如するという点で,消化管の飢餓状態を引き起こすともいえる.この消化管の飢餓状態は,本来の飢餓同様,侵襲に対する生体防御能を低下させることが基礎研究によって明らかになっている(図Ⅳ)(参考文献3-3-7).このため,細菌性肺炎や呼吸器ウイルス感染,腸管内・門脈内への緑膿菌大量投与,細菌性腹膜炎モデルでの生存が,経腸的な栄養管理を受けていた群に比べ悪化する.早期経腸栄養や栄養管理法として経口摂取・経腸栄養が推奨されるゆえんである.
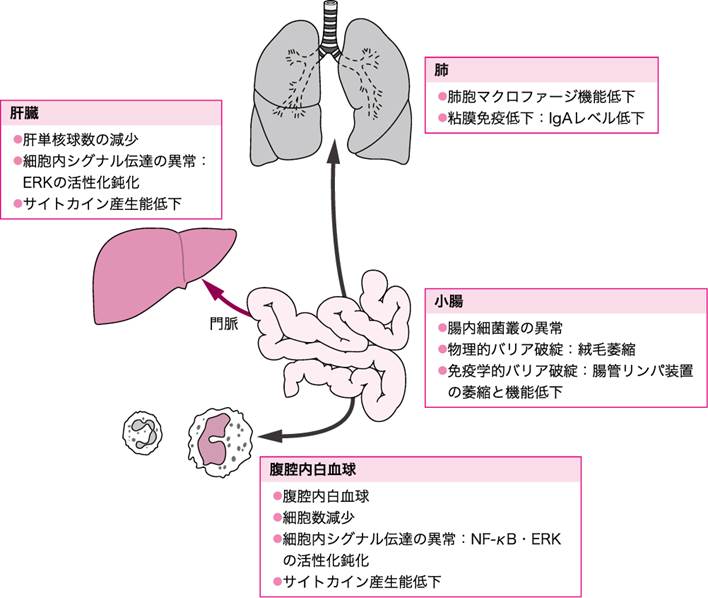
図Ⅳ●消化管の飢餓によって惹起される生体防御能低下
■おわりに
飢餓と侵襲に対して生体は必要とされるエネルギーの産生を満たすために代謝を変動させる.しかし,飢餓では体タンパクの崩壊を最小限に抑えるように,代謝率の低下・エネルギー基質の糖からケトン体への変換で対応するのに対し,侵襲時には侵襲の大きさに比例して代謝を亢進させ大量のタンパク異化を引き起こす.それは,侵襲時の生体防御能を高めるために不可欠な反応で,飢餓状態で大きな侵襲が加わると生体は防御機構を強化することができず生命の危機に直面する.侵襲に対し適切な生体反応を生じ生命を維持するためには,侵襲前・後の飢餓状態の回避・適切な栄養管理が重要である.
関連キーワード
· [1] 腹腔内白血球[peritoneal leukocyte]
· [2] 腸管虚血再灌流[gut ischemia reperfusion]
免疫とは
■概論
免疫とは「自己」と「非自己」を生物学的に識別し,「非自己」からの攻撃を排除して「自己」の生命を維持する生体の働きをいう.体外から皮膚や粘膜を越えて体内に侵入しようとする微生物などの病原体を防御し,さらには侵入しようとする病原体の排除を行っている.また病原体に感染した細胞や腫瘍細胞などの異常細胞を排除する役割も果たしている.一方で,免疫機能が正常に働かない場合,免疫は易感染性,アレルギー,自己免疫疾患,悪性腫瘍など生体にとって不利な反応をきたす.
ヒトをはじめとする高等動物において,免疫機能は免疫細胞(白血球)およびリンパ器官をはじめとするさまざまな器官・組織・細胞によって構成される.免疫細胞は骨髄内の造血幹細胞が分化した,骨髄系前駆細胞とリンパ系前駆細胞に由来する.骨髄系前駆細胞は顆粒球(好中球,好酸球,好塩基球,マスト細胞),単球(マクロファージ,樹状細胞)に分化し,リンパ系前駆細胞はリンパ球(B細胞,T細胞,NK細胞)に分化する.それぞれが末梢血や末梢組織に移行して機能する(図Ⅰ).
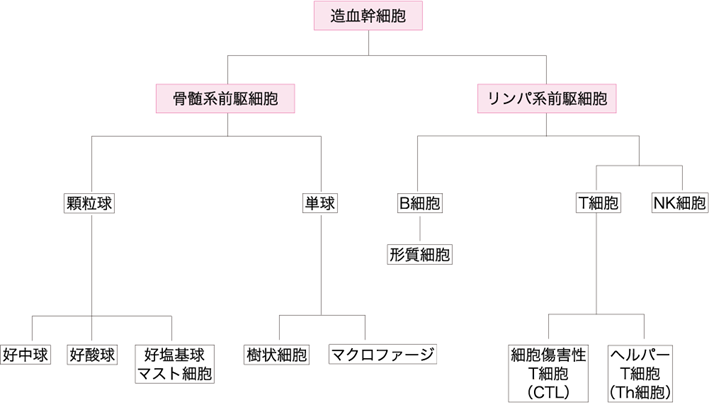
図Ⅰ●免疫系の主な細胞
造血幹細胞から分化した骨髄系とリンパ系に由来する.骨髄系は顆粒球と単球に,リンパ系はB 細胞とT 細胞,NK 細胞に分化して免疫の働きを担う.
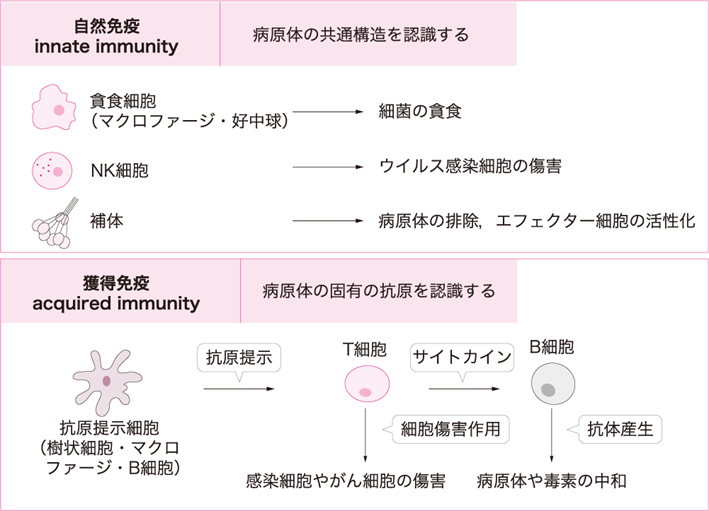
図Ⅱ●免疫応答の概要
免疫応答は,前感作を必要としない自然免疫と,抗原刺激により後天的に誘導される獲得免疫に大別される.
免疫は,自然免疫(innate immunity)と獲得免疫(acquired immunity)に分類される(図Ⅱ).自然免疫は抗原による前感作を必要とせず,生まれながらに生体に備わっている防御機構である.自然免疫は,病原細菌を貪食する好中球やマクロファージなどの貪食細胞,ウイルス感染細胞を傷害するNK細胞が主体となる.また,自然免疫は幾種類もの微生物抗原などと反応する自然抗体,また自らは抗原特異性をもたないが抗体の働きを補助して生体防御をもたらす補体を総称する.加えて自然免疫は生体を外敵から守る基盤的な防御能であると同時に,獲得免疫機能の活性化にも働く.すなわち,Toll様受容体(Toll-like receptor:TLR)を介して活性化したマクロファージや樹状細胞が抗原提示細胞として主要組織適合遺伝子複合体(major histocompatibility complex:MHC)分子とともにT細胞へ抗原を提示することで選択的に活性化させ,獲得免疫を起動しエフェクター活性を高める.これに対し獲得免疫は,生体が生後抗原と接触することにより後天的に獲得する免疫をいう.獲得免疫はリンパ球と貪食細胞の両方がかかわり,液性免疫と細胞性免疫に二分される.液性免疫は骨髄で分化・成熟したB細胞が分化して形質細胞となった後につくられる抗体(免疫グロブリン)により調節される.細胞性免疫はマクロファージや樹状細胞により活性化されたT細胞のうちCD4+T細胞がヘルパーT細胞(Th細胞)に分化し,CD8+T細胞が細胞傷害性T細胞(cytotoxic T lymphocyte:CTL)に分化することにより働く.Th細胞はIFN-γをはじめとしたサイトカインを産生しマクロファージや好中球の機能を活性化する.またCTLはTh1細胞からのIL-2によりCD8+T細胞が活性化されることで増殖する.その結果CTLによって感染細胞や腫瘍細胞の破壊が行われる.
関連キーワード
· [2] NK細胞[natural killer cell]
· [4] 抗原提示細胞[antigen presenting cell]
消化管と免疫
■概論
腸管は,腸蠕動や腸絨毛・粘液の被覆によるバリアー構造,粘液内のchemical agentsによる抗菌活性,マクロファージによる貪食などにより,外界からの細菌や毒素の体内への侵入を阻止している(図Ⅰ).腸管は,腸管関連リンパ組織(gut-associated lymphoid tissue:GALT)を有し,絶えず膨大な種類と量の異物(細菌,ウイルス,食物性タンパクなど)にさらされている.腸管は,安全な食物ならば生命維持に必要なものとして受け入れて体内に取り込み,病原性のある細菌は可及的すみやかに排除する識別機構を備えており,第二の脳(the second brain)ともよばれている.
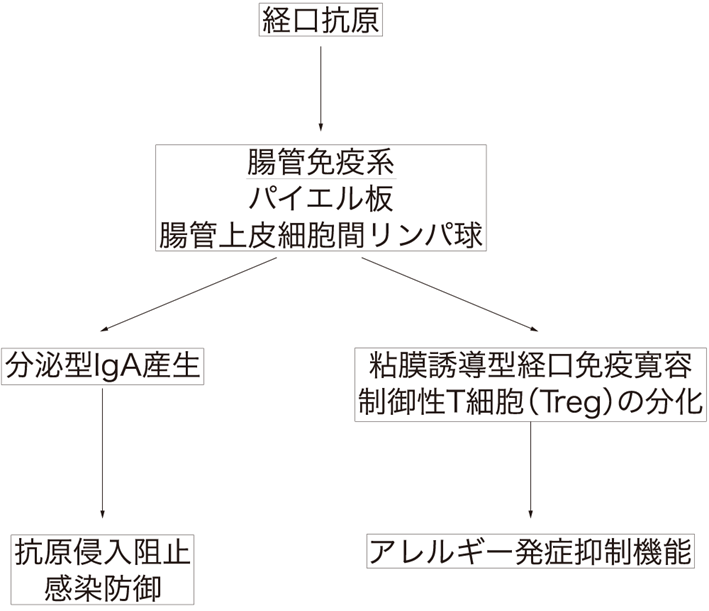
図Ⅰ●腸管免疫系
腸管免疫系では,経口抗原に対してパイエル板および腸管上皮細胞間リンパ球において抗原に特異的な反応をきたす.原菌が侵入した場合にはIgA が産生され,防御する.
また粘膜誘導型経口免疫寛容ではアレルギー発症抑制に関与している.
腸管免疫系を構成しているのは小腸上皮細胞,粘膜固有層,腸粘液層,パイエル板,孤立リンパ小節(isolated lymphoid follicles:ILFs),粘膜固有層リンパ球(lamina propria lymphocytes:LPLs),腸管上皮細胞間リンパ球(intraepithelial lymphocytes:IELs),腸間膜リンパ節,クリプトパッチ(cryptopatch:CP),形質細胞(plasma cell),マクロファージ,樹状細胞,好酸球,マスト細胞である(参考文献4-2-1).IELs,LPLsに存在するCD4+T細胞とCD8+T細胞を合わせた数は,全免疫系細胞のおおよそ60%を占めるともいわれる.これらのCD4+T細胞とCD8+T細胞は,経口的に体内に取り込まれる多量の抗原がM細胞を通過した後に抗原提示細胞により抗原提示されると,パイエル板における分泌型IgAの産生とともに生体防御の最前線として重要な役割を担っている.
分泌型IgAは,粘膜固有層の形質細胞により産生されて粘膜を介して腸管内に分泌される.殺菌作用は認めないが,毒素の中和や抗ウイルス抗体,抗細菌抗体など遮断抗体活性を示し,病原体やアレルゲンの腸管粘膜からの侵入を阻止する,感染防御に重要な免疫グロブリンである.感染は侵入性の細菌やウイルスなどの微生物が標的細胞(上皮細胞)の表面に接着することから開始されるが,分泌型IgAはこれらの微生物と特異的に結合することで微生物が上皮細胞に接着するのを阻止する.また,分泌型IgAは細菌が産生する毒素に対しても中和作用を示し,さらに食物中に含まれるアレルゲンと結合して食事性抗原の体内への吸収を阻止している.
一方で,食事性抗原にアレルギー反応や拒絶反応を起こさせないようにする抗原特異的な免疫学的無反応(粘膜誘導型経口免疫寛容)もまた腸管免疫機構の特徴の1つである(参考文献4-2-2)~(参考文献4-2-4).経口摂取されたタンパク抗原に対して,腸管において,Th1細胞,活性化マクロファージ,NK細胞のサイトカイン合成をブロックする合成抑制因子のIL-10や抑制性サイトカインのTGF-βを高産生するTreg細胞がパイエル板内に誘導され,経口免疫寛容における重要な役割を担っている(参考文献4-2-5),(参考文献4-2-6).免疫系を正常に保つにはTh2/Th1バランスが重要で,Th1細胞が多いと自己免疫疾患となる可能性が高くなり,Th2細胞が優位だとアレルギー疾患が起こりやすいといわれている.Tregは両方の過剰な産生を抑制し,免疫寛容を調節する.
関連キーワード
· [1] 腸管関連リンパ組織(GALT)[gut-associated lymphoid tissue]
· [2] 孤立リンパ小節(ILFs)[isolated lymphoid follicles]
· [3] 腸管上皮細胞間リンパ球(IELs)[intraepithelial lymphocytes]
· [4] 粘膜固有層リンパ球(LPLs)[lamina propria lymphocytes]
· [5] クリプトパッチ(CP)[cryptopatch]
· [6] 粘膜免疫循環帰巣経路(CMIS)[common mucosal immune system]
· [7] 栄養不良と免疫機能低下[decline of immune functions by malnutrition]
腸内細菌と栄養
■概論
成人の腸管内には人体の菌の70%以上が生着し,約1,000種,100兆~1,000兆個の細菌が宿主と利益を共有していて,その大部分は結腸に存在している.腸内細菌は,エネルギーの供給促進,病原菌の腸内増殖とその定着の防止,正常な腸管免疫の維持や促進に重要な役割を担っている.腸内細菌の構成の割合は,近年では出生前の状態,出生方法,出生後の哺乳状況や環境,その後の食事・栄養摂取の影響などを受けて生涯を通じて変化する.
腸内細菌叢を良好な状態に維持することは,免疫の基盤となる生体防御能を適正に保持するうえで重要である.腸内細菌叢は,抗菌薬の使用時や,偏った食事や病原体感染などによって宿主の免疫能が低下することでdysbiosisを生じる.このような腸内細菌叢を良好な状態に維持するためのものとしてプロバイオティクスやプレバイオティクスの有効性が示されている.プロバイオティクスは生体にとって有益な作用を示す特定の生菌であり,具体的な属としては乳酸菌などが属するLactobacillus属やビフィズス菌などのBifidobacterium属などが利用されている.プレバイオティクスは乳酸菌やビフィズス菌などの餌となるもので,これによりプロバイオティクスの効果が促進する.
また,資化されて生成増加した短鎖脂肪酸(酪酸,酢酸,プロピオン酸)によっても,大腸の機能の多くは維持されている.短鎖脂肪酸は,大腸上皮細胞のエネルギー源(酪酸),宿主のエネルギー源(酢酸,プロピオン酸)となり,また大腸管腔内pH低下をきたし腸内細菌叢の改善を促すだけでなく,下部小腸や結腸に存在するL細胞が短鎖脂肪酸受容体の刺激によりGLP(glucagon-like peptide)やPYY(peptide YY)を放出することで,腸粘膜の増殖や代謝亢進などの作用をきたす.一方,上皮細胞の増殖や粘液の分泌が不十分な場合には,粘膜のバリアー機能が低下しているので,細菌や毒素が腸管内から体内に侵入するバクテリアルトランスロケーションをきたす.
このような状態の変化しやすい腸内細菌叢を維持するために,前述のプロバイオティクス・プレバイオティクスを併用したシンバイオティクスがさらなる有効性を認めている.
また,直接,あるいは腸内細菌叢を介して産生された生体反応修飾物質を含む食品成分(バイオジェニックス)は,免疫強化,血圧降下・コレステロール低下・整腸作用,抗腫瘍効果などの生体調節・生体防御・疾病予防・回復・老化制御に寄与する効果をもたらす.バイオジェニックスには死菌成分も含まれており,抗原がM細胞から取り込まれ抗原提示されることにより,サイトカイン産生を促進することで免疫賦活効果をもたらすとされる.
関連キーワード
· [1] 腸内細菌叢の働き[effects of intestinal bacterial flora]
· [2] 腸内細菌と疾患[intestinal bacteria and disease]
· [8] 水溶性食物繊維[soluble dietary fiber]
· [9] 短鎖脂肪酸[short-chain fatty acid]
· [10] バクテリアルトランスロケーションの原因[bacterial translocation]
栄養スクリーニング・アセスメント
■栄養スクリーニング・アセスメントの概略
栄養スクリーニング・栄養アセスメントは栄養ケアを実施する一連のプロセスの第一歩である(図Ⅰ).栄養障害(またはそのリスク)のある対象者を抽出し,栄養状態を評価することは重要である.栄養障害,なかでも低栄養あるいはその疑いがある対象者を抽出することを「栄養スクリーニング」とよび(参考文献5-1-1),さまざまなツールが開発されている.これに対して,栄養スクリーニングで低栄養のリスク抽出された患者に対してより詳細に栄養状態を評価することを「栄養アセスメント」とよぶ(参考文献5-1-1).また,低栄養に関しては近年国際的な診断基準の枠組みが開発され(参考文献5-1-2),栄養アセスメントとは別に「低栄養の診断」を行うことが可能となった.
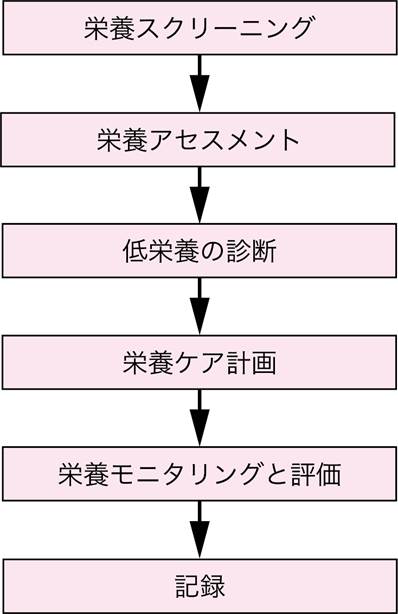
図1●栄養ケアのプロセスにおけるスクリーニング・アセスメントの位置付け
※栄養スクリーニングは栄養アセスメントを必要とする患者の抽出,栄養アセスメントはそれに続く栄養ケア計画の立案に必要な情報の収集と解釈を目的として実施する.
(文献5-1-1をもとに作成)
■栄養スクリーニングの定義と評価ツール
栄養スクリーニングは低栄養あるいはそのリスクがある対象者を簡便・迅速な方法で抽出することを指す(参考文献5-1-1).体重減少,現体重(body mass index:BMI),食事摂取量,急性疾患・ストレスの影響などの項目から構成され,おおむね5 分以内で評価を完了できることが特徴である.高齢者向け,在宅向け,急性期向けなどさまざまな栄養スクリーニングツールが開発されているが,妥当性・信頼性が検証されたツールを用いることが望ましい.妥当性が検証ずみの代表的なツールとして,高齢者向けのMNA-SF(Mini Nutritional AssessmentShort-Form)(参考文献5-1-3),在宅・病院など幅広いセッティングで使用可能なMUST(MalnutritionUniversal Screening Tool)(参考文献5-1-4),主に急性期病院向けのNRS2002(Nutritional RiskScreening)(参考文献5-1-5)などがある.
■栄養アセスメントの定義と評価法
栄養アセスメントは管理栄養士などの栄養専門職が実施する詳細な栄養状態の評価を指 し,栄養状態・疾患重症度や代謝亢進の程度・体重変化・体組成・栄養/食事歴・薬歴など
のさまざまな情報を総合的に判定することである.栄養アセスメントを行う目的は栄養学的 問題の原因や程度の判定,栄養ケアプランの基盤となる情報の提供である(参考文献5-1-6).
A. 栄養アセスメントツール
栄養アセスメントを網羅的に実施するためのツールとして,主観的包括的評価MNA(Mini Nutritional
Assessment)(参考文献5-1-7),SGA(Subjective Global
Assessment)(参考文献5-1-8),PG-SGA(Patient-generated SGA)(参考文献5-1-9)などがある.それぞれ構成要素は異なるが,体重減少や消化器症状,疾患・外傷によるストレスや代謝亢進,創傷の有無,食事摂取量や内容の変化などの項目を含み,最終的に低栄養の有無や程度を判定することができる.SGAは“主観的に栄養状態を評価することや主観的な栄養指標”の意味でも用いられることもあるが,一般的には「SGAという手法」を指す(参考文献5-1-8).PG-SGAはSGAを改良したもので,患者自身が評価する項目と医療者が評価する項目とに分かれている.MNAは高齢者向けに開発された18項目の栄養アセスメントツールであり,MNA-SFはMNAの初期6項目を独立させたものである.
B. 栄養評価指標
栄養アセスメントに用いられる評価指標には,①身体計測,②体組成分析,③病歴・治療歴,④栄養・食事歴(栄養摂取量を含む),⑤身体検査(フィジカルアセスメント),⑥臨床検査(血液・尿など),⑦機能検査,などがある.このうち身体計測や臨床検査などの数値化できる指標を,SGAと対比させて客観的栄養評価(objective
data assessment:ODA)とよぶことがある(参考文献5-1-10).また,血清アルブミン値のように代謝回転が比較的遅い生化学的指標や身体計測値など,現時点での普遍的な栄養状態を指す指標を用いる静的アセスメント,急性相タンパク質(rapid turnover protein)のように代謝回転の速い血清タンパク質や窒素出納などを用いて経時的な栄養状態の変動を評価する動的アセスメント,複数の栄養評価指標を組み合わせて治療予後や合併症などを予測する予後推定アセスメントがある(参考文献5-1-10).予後推定指標は栄養リスク指標ともよばれ,PNI(Prognostic Nutritional Index),NRI(Nutritional Risk Index),GNRI(Geriatric
Nutritional Risk Index)などがある(参考文献5-1-11),(参考文献5-1-12).ただし,これらに用いている生化学的指標は現在のコンセンサスでは栄養指標というより炎症反応や疾患重症度の指標とみなされていることに注意したい(参考文献5-1-2).
■低栄養の診断基準
近年,複数の国際学会主導で低栄養の診断基準が開発された.これまで,低栄養のゴールドスタンダードとよべる診断基準は存在しなかったが,2018年に臨床栄養に関連する世界4学会(米国静脈経腸栄養学会,欧州臨床栄養代謝学会,アジア静脈経腸栄養学会,南米静脈経腸栄養学会)によるワーキンググループ(Global Leadership Initiative on Malnutrition:GLIM)が低栄養の国際基準を公表した(GLIM基準)(参考文献5-1-2).GLIM基準は栄養スクリーニングでリスク評価を行った後,表現型基準と原因基準に該当すれば低栄養と判断するものである.今後,臨床現場では栄養スクリーニング・栄養アセスメントと並んで低栄養診断が実施されるようになるだろう.
関連キーワード
· [1] 栄養スクリーニング[nutrition screening]
· [2] 栄養アセスメント[nutritional assessment]
· [3] MNA-SF[Mini Nutritional Assessment Short-Form]
· [4] MUST[Malnutrition Universal Screening Tool]
· [5] NRS2002[Nutritional Risk Screening]
· [6] MNA[Mini Nutritional Assessment]
· [7] SGA[Subjective Global Assessment]
· [8] PG-SGA[Patient Generated-SGA]
· [9] ODA[objective data assessment]
· [10] PNI[prognostic nutritional index]
· [11] GNRI[Geriatric Nutritional Risk Index]
· [12] GLIM基準[Global Leadership Initiative on Malnutrition]
身体計測
■身体計測の意義
体組成変化は栄養障害の重要な指標である.体組成は脂肪・除脂肪量(体細胞成分,細胞内水分を含む)・細胞外水分・骨などにより構成されている(図Ⅰ)(参考文献5-2-1),(参考文献5-2-2).脂肪の増加は冠動脈疾患や糖尿病のリスクを増加させうるし,逆に体細胞成分(骨格筋)の減少は低栄養を示唆する所見である.身体計測はこのような体組成の変化を評価するための最も簡便な手法であり,臨床現場にも広く普及している.身体計測の長所は簡便・安価・非侵襲的である点で,栄養専門職の数が少なく侵襲的検査の実施が困難な状況(在宅など)においては有力な選択肢となる.一方で測定者間・測定者内の誤差が大きいこと,一部の検査では測定スキルを要することが短所である(参考文献5-2-3).
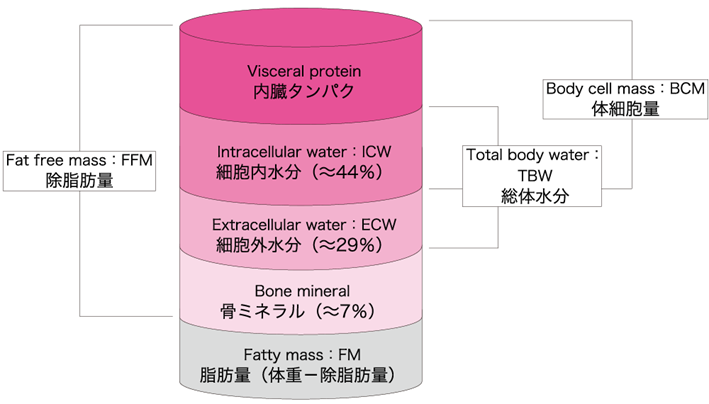
図Ⅰ●体構成成分
(文献5-2-2より引用)
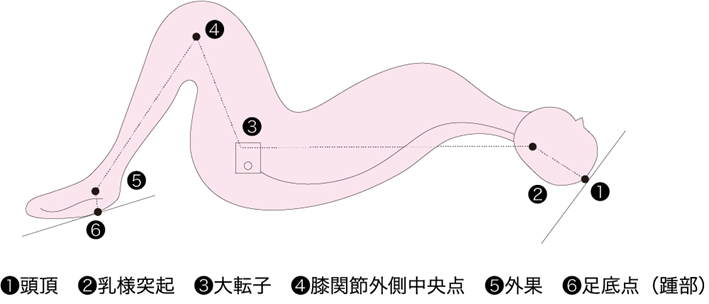
図Ⅱ●石原法による身長測定
(文献5-2-6より引用)
最も基本的な身体計測値は身長と体重である.身長は身長計あるいはメジャーで測定するが,測定が困難な場合(円背や起立不可の場合)は石原法(参考文献5-2-4),(参考文献5-2-5)や膝高(knee height:KH)からの推定式(参考文献5-2-6)を用いて算出可能である(図Ⅱ).体重は校正ずみ体重計を用いて測定することが望ましい.測定可能の場合は身長,体重からBMI(body mass index)を算出する〔体重(kg)÷身長(m)2〕.また理想体重(ideal body weight:IBW)や通常時体重(usual body weight:UBW)も栄養障害の有無や変遷を評価できる有用な指標である.体重が測定できない場合は膝高から算出することが可能である(参考文献5-2-6).
貯蔵エネルギー(体脂肪量)や貯蔵タンパク質(骨格筋量)の程度を推定するための身体計測法として,上腕や下腿を測定する方法がある.上腕周囲長(arm circumference:AC)は体脂肪量と骨格筋量を,上腕三頭筋部皮下脂肪厚(triceps skinfold thickness:TSF)は体脂肪量を反映する指標であり,それぞれメジャーとキャリパーを用いて測定する.この2つの値を用いて算出する上腕筋囲(arm muscle circumference:AMC),上腕筋面積(arm muscle area:AMA)はいずれも骨格筋量を反映するとされている.またTSFと同じく体脂肪量を反映する指標として肩甲骨下部皮下脂肪厚(subscapular skinfold thickness:SSF)がある.一方,メタボリックシンドロームの診断基準としても用いられる腹囲(waist
circumference:WC)は脂肪量だけでなく分布(内臓脂肪の多寡)を反映する指標であり,死亡リスクとも相関する(参考文献5-2-7),(参考文献5-2-8).
近年,高齢者を中心としてサルコペニアが問題となっており,骨格筋量の測定が普及してきている.下腿周囲長(calf circumference:CC)は四肢骨格筋量とよく相関し(参考文献5-2-9),体組成分析機などが使用できない状況において四肢骨格筋量を推定するのに有用である.また身体計測値とは異なるが,近年では握力(handgrip strength:HG)が栄養指標の1つとして考えられるようになってきている(参考文献5-2-10).握力はスメドレー式握力計を用い,直立姿勢で測定することが望ましい(参考文献5-2-11).
関連キーワード
· [1] 理想体重(IBW)[ideal body weight]
· [2] 通常時体重(UBW)[usual body weight]
· [4] 上腕周囲長(AC)[arm circumference]
· [6] 肩甲骨下部皮下脂肪厚(SSF)[subscapular skinfold thickness]
· [7] 上腕筋囲(AMC)[arm muscle circumference]
· [8] 上腕筋面積(AMA)[arm muscle area]
· [9] 下腿周囲長(CC)[calf circumference]
· [10] 腹囲(WC)[waist circumference]
· [11] 握力(HG)[handgrip strength]
臨床検査
■概論
臨床検査は日常の診療において欠かすことのできないものである.病気の有無にはじまり,疾患があった場合には,その症状を正しく診断・評価するのに役立つだけでなく,正常な健康状態およびさまざまな病気を詳細に解析し,患者1人1人の全身状態を把握するためにも重要である.栄養面に限ったことではなく,医師のみならず看護師,薬剤師,栄養士,検査技師などの「医療人」は臨床検査値を熟考する必要がある.もちろん検査値の数字がすべてではないが,検査値をふまえて総合的に検討し,臨床へ評価をフィードバックすることが必要とされている.臨床検査には各診療科の患者の血液を用いての血液一般検査,生化学検査,尿や便の検査などの生体試料を用いる検査のほか,心電図,脳波,肺活量検査なども含まれる.病院内の一般の診療科が目に見える樹木だとすると,検査はその「根」の部分にあたる存在であり,陰ながら臨床の現場への貢献をめざすものだと考えられる.
このように病態の把握や診断に欠かせない臨床検査だが,以下のキーワードでは「栄養」という観点からみた際に,特に臨床で重要となる項目について解説する.なお,疾患ごとの検査項目の例を表Ⅰに示した.

(文献5-3-1より引用)
関連キーワード
· [1] 血清総タンパク(TP)[total protein]
· [3] トランスサイレチン(TTR)[transthyretin]
· [4] レチノール結合タンパク(RBP)[retinol-binding protein
· [5] トランスフェリン(Tf)[transferrin]
· [6] 総コレステロール(TC)[total cholesterol]
· [7] トリグリセリド(TG)[triglyceride]
· [10] ヘマトクリット(Ht)[hematocrit]
· [12] 総鉄結合能(TIBC)[total iron binding capacity]
· [13] 不飽和鉄結合能(UIBC)[unsaturated iron binding capacity]
· [15] 総リンパ球数(TLC)[total lymphocyte count]
· [16] 遅延型皮膚反応(DTH)[delayed type hypersensitivity]
· [17] C反応性タンパク(CRP)[C-reactive protein]
· [18] 尿素窒素(BUN)[urea nitrogen]
· [19] 尿中尿素窒素(UUN)[urine urea nitrogen]
· [20] 尿中クレアチニン(U-Cre)[urea-creatinine]
· [21] 尿中3メチルヒスチジン(3-MHIs)[urea 3-methyl histidine]
■フィジカルアセスメントの概要
A. 臨床栄養におけるフィジカルアセスメント
臨床栄養においては,栄養状態を評価する際に,栄養歴・各種検査値の評価およびフィジカルアセスメントを実施することが望ましい.視診,触診,器具を使用した身長・体重・体温計測,および聴診など多角的に栄養状態を評価する.
B. フィジカルアセスメントの実践
① 外観
ADL(activities of daily living,日常生活活動)や着衣などを観察する.
・ADL:栄養管理を進めていくうえでゴール設定に必要である.自分で料理や買いものが可能か,栄養指導が理解できるか,座位で食事が可能か,などをアセスメントする
・着衣:緩すぎる着衣の場合は急激な体重減少が,きつすぎれば体重増加が疑われる
② 頭部
意識レベル(JCS)や毛髪の状況を観察する.
・意識レベル:栄養管理を実施するうえで意識レベルの評価は重要事項である
・毛髪:脱毛・スキンヘッドであれば化学療法中の可能性が,年齢不相応な白髪があれば悪性貧血が疑われる.クワシオルコルではタンパク質の欠乏によって,脱毛,毛髪の退化・赤色化が起きる
③ 顔面
顔貌から栄養状態を推測する.また,口腔内や眼球・眼瞼も観察する.
・口腔内:口腔内アセスメントを行う
・眼球・眼瞼:落ちくぼんでいれば脱水症や栄養不良が,突出していればバセドウ病が,浮腫があれば体液過剰が,黄染していれば黄疸が疑われる.眼瞼結膜を観察することで貧血の有無が観察可能である
④ 頸部
喉頭の動きおよび外頸静脈を観察する.
・嚥下機能:嚥下の際に,後頭筋が連動して動くか観察する
・外頸静脈:座位で怒張があれば体液過剰,仰臥位で虚脱があれば脱水症を疑う
⑤ 上腕・前腕・手指
筋肉,脂肪,および体液の状態を観察する.
・筋肉・脂肪:上腕周囲長や脂肪厚が計測される
・手指・握力:栄養管理を実施していくうえで,指示動作が入るか否か,握力や筋量がどうか,末梢循環がどうか,の3点を評価する.特に,握力は血清アルブミン値よりもリアルタイムでタンパク合成を評価することが可能とされている
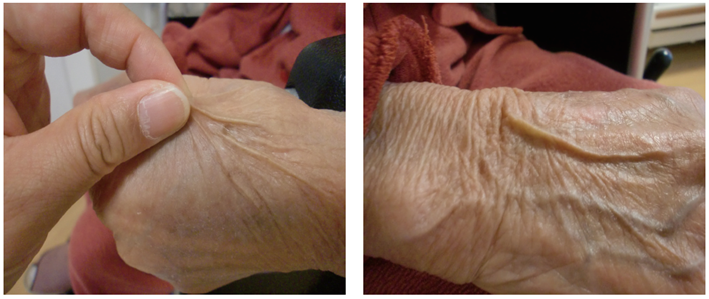
・脱水症:脱水症では,ツルゴール(皮膚緊張)が消失する(図Ⅰ).毛細血管再充満時間(capillary refill time:CRT)が延長する(図Ⅱ).脱水症の重症度判定にフィジカルアセスメントが活用される
図Ⅰ●ツルゴール(皮膚緊張)
通常では皮膚をつまんで離すとしわができ,その後,もとの状態に2秒以内に復する.脱水症では,もとの状態に復するのに3秒以上を要する.
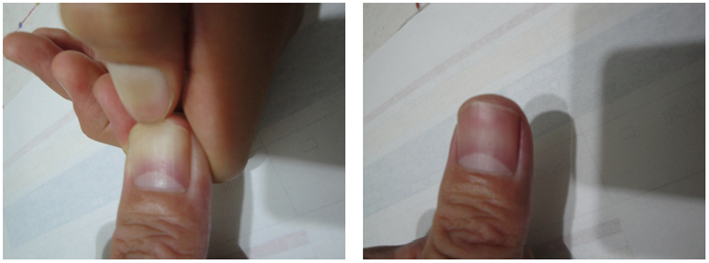
図Ⅱ●毛細血管再充満時間
爪を圧迫し爪床の色が赤色から白色に変わったときに圧迫をやめる.その時点から,正常では2秒以内に赤色に戻る.3秒以上かかれば脱水症,循環不全が疑われる.
⑥ 肩部,背部,胸部
呼吸状態,筋肉の状況を観察する.
・呼吸状態:呼吸状態をみるときには,回数・深さ・呼吸様式・リズム・呼吸音などを評価する.食事摂取に関連した気道の異常(アナフィラキシーショック,気道狭窄,誤飲のサイン)の場合もある
・肩部・背部:肩の後ろの筋肉(三角筋)に触って,筋肉量を観察する
・胸部:肋間筋が減少し肋骨が露出していれば栄養不良が疑われる
⑦ 腹部
蠕動を確認し腸管が使用できるか否かの判断材料とする.
・腸管蠕動音:聴診器を使用した腸管蠕動音のアセスメントは実施しておきたい
・腹水・脂肪の評価:肝硬変や低栄養では腹水が,過栄養では腹部の脂肪が増加している
⑧ 下腿
浮腫や末梢循環を観察する.
・筋肉量の評価:大腿四頭筋を触診する
・浮腫の評価:脛骨前面を指で10秒間程度圧迫して離し,その後,数分経っても圧迫痕が消失しなければ浮腫と診断される
・末梢循環:下肢の冷感,爪床が青白く変化,などから末梢循環不全が疑われる
⑨ 体組成
身長,体重などの他,体組成計により筋肉・脂肪・体液量が計測される.
⑩ 尿・便
回数,量,性状(色,臭い),定性試験などが実施される.便の性状はKing’s Stool Chartを使用して1日の便量を点数化する.
⑪ 体温
体温と栄養管理の関係をよく理解する.
関連キーワード
· [1] フィジカルアセスメント[physical assessment]
· [2] 顔貌と栄養状態[facial configuration and a nutrient state]
· [4] 口腔内アセスメント[assessment in the mouth]
· [5] 食事摂取に関連した気道の異常[airway disorder relevant to dietary intake]
· [6] 脱水症の重症度判定[severity-of-illness judging of dehydration]
· [7] 腸管蠕動音のアセスメント[assessment of bowel sound]
· [8] 体温と栄養管理[body temperature and nutrition management]
食生活状況の把握
■食生活状況把握の目的と概要
患者の食生活状況の把握は,栄養状態の評価に用いるだけでなく,栄養療法の方向性を検討するうえで重要となる.食事の摂取状況と臨床検査値などの客観的指標を組み合わせて評価することで,より多面的な栄養アセスメントにつなげることができる.また,栄養療法の目標は患者の病状や治療方針に合わせて設定するため,個人の嗜好や摂取状況に合わせた栄養療法が必要となる.つまり,適切な栄養療法を行うためには,食事調査から得られた情報を評価し,栄養療法に活かさなければならない.
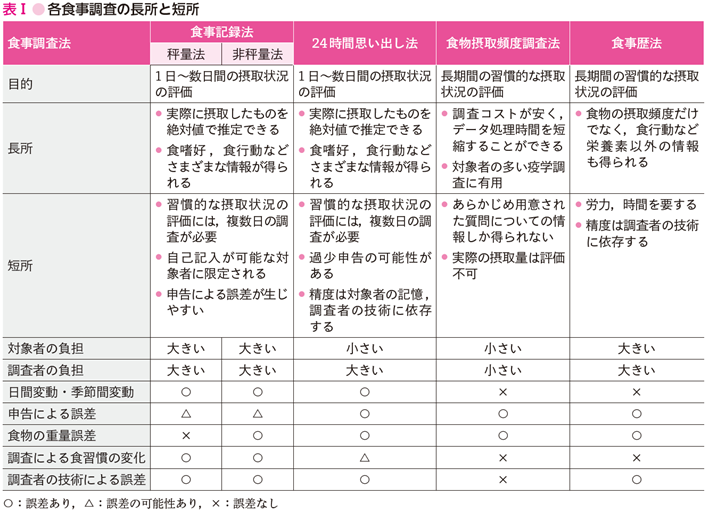
食事調査の方法には,①調査開始時から摂取したものを前向きに調査する方法(食事記録法,写真撮影法),②調査開始以前に摂取したものを後ろ向きに調査する方法(24時間思い出し法,食物摂取頻度調査法,食事歴法),③複数の調査方法を組合わせる方法があり,対象者や目的に応じて使い分ける必要がある.例えば,食事記録法や24時間思い出し法は1日~数日間の摂取状況を,食物摂取頻度調査法や食事歴法は1カ月以上の長期間の摂取状況を把握するのに適している.いずれにせよ,調査に要する時間や労力,精度,コストの問題を考慮して調査方法を選択するとよい.加えて,食事調査法ではさまざまな要因により測定誤差が生じることを理解しておく.献立や摂取量は日々異なり,季節によって食事内容も変化する(日間変動・季節間変動).
また,食事調査では対象者の申告漏れがあれば,正確な情報は得られない.さらに,菓子類やアルコールなど,対象者が好ましくないと思っている食品を過少に申告する可能性もある.つまり,正確に摂取状況を把握することは決して容易ではなく,食事調査はいかに誤差を抑えて調査するかが鍵となる(参考文献5-5-1)~(参考文献5-5-3)(表Ⅰ).
また,ここ数年で食事調査法は大きな変化を遂げている.例えば,携帯電話やスマートフォンの普及により,写真撮影法はより簡便に行える調査方法となった.若年の患者では,食事記録法より写真撮影法の方が抵抗なく実施してもらえる場合がある.さらに,食事内容を入力して摂取量を評価するシステムが開発されており,より簡便に精度が高い食事調査が行えるようになっている(参考文献5-5-4).
また,入院患者の食事摂取状況を把握するためには,前述の方法に加え,残菜調査が用いられる.給食の摂取状況から必要栄養素量を充足しているか確認し,栄養状態のアセスメント,栄養療法に活用する.摂取状況と客観的指標の推移を評価することで,入院中の栄養状態の変化を把握することができる.
関連キーワード
· [1] 外来患者の食生活状況調査[dietary assessment]
· [3] 24時間思い出し法[24-hour recall]
· [4] 写真撮影法[photographic method]
· [5] 食物摂取頻度調査法[food frequency method]
· [7] 入院患者の食事調査[dietary assessment]
· [8] 残菜調査[methods of plate waste measurement]
2 理学療法とグルコースコントロール
栄養療法の種類
■栄養投与経路の種類
栄養投与経路は,経腸栄養(enteral nutrition:EN)と静脈栄養(parenteral nutrition:PN)がある(表Ⅰ).経腸栄養には,口から飲んだり食べたりする経口栄養と,経管栄養がある.そして経管栄養は,経鼻アクセスや消化管瘻アクセスを用いて経腸栄養剤を投与する.

一方,静脈栄養には,末梢静脈内に栄養素を投与する末梢静脈栄養(peripheral
parenteral nutrition:PPN)と,中心静脈にカテーテルを留置して栄養素を投与する中心静脈栄養(total parenteral
nutrition:TPN)がある.
消化管機能のアセスメント,すなわち消化吸収能が十分機能しているか,どのレベルから消化管が機能しているのか,などを評価し,さらに栄養補給の必要な期間を想定して,栄養投与経路を決定する.その際,誤嚥の有無や,全身状態,基礎疾患などを考慮して,個々の症例において最も生理的な栄養補給法を選択することが大切である.
■栄養投与経路の選択基準
栄養療法の大原則は,“When the gut works, use it !”「腸が働いているなら,腸を使おう!」である.腸が機能しており,安全に使用可能であれば,原則的に経口栄養,経管栄養を施行する(図Ⅰ).経口摂取が可能で,摂取量が少なければ,まずは経口からの経腸栄養剤内服などによる栄養補助を考慮する.嚥下障害などで栄養が口から摂取できないときは,経管栄養を選択する.栄養補給が一時的,短期間の場合は,鼻から胃や十二指腸,空腸にカテーテルを入れ,経鼻カテーテルからの栄養法を選択する.期間が4週間以上の長期になる場合は,胃瘻,腸瘻からの栄養法を選択することが勧められる.多発性脳硬塞で摂食嚥下障害を示す寝たきり高齢者の場合は,腸は機能しているが,経口摂取はできず,その栄養療法の期間は長期にわたるため,胃瘻からの栄養法が選択されることになる.
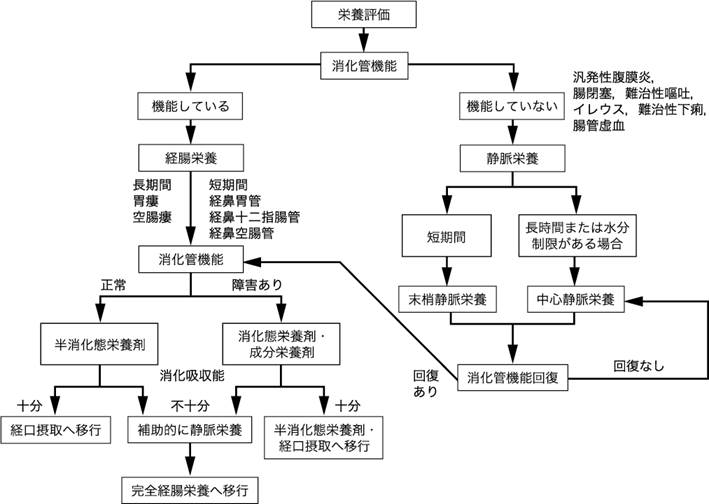
図Ⅰ●栄養補給のための投与ルートのアルゴリズム(ASPEN)
(文献6-1-1より引用)
一方,静脈栄養の適応は,腸が機能していない場合である.
①腸を使った栄養法である経口栄養,経腸栄養が困難な場合,
②消化管が安全に使用できない場合,
③静脈からの栄養補給が有利な場合,などがある.
腸閉塞や高度の下痢症など消化管の機能が侵されていて,消化管が安全に使用できない場合は,やむをえず静脈栄養法を選択することになる.静脈栄養法は,2週間未満の比較的短期間の場合にはPPNを,2週間以上の長期の場合にはTPNを選択するのが原則となる.
米国静脈経腸栄養学会(ASPEN)の栄養療法のアルゴリズムでも,消化管機能が維持され,消化管が使用可能であり,経腸栄養が禁忌であるような病態でない限り,経腸栄養を選択すべきとしている(図Ⅰ)(参考文献6-1-1).そして,経腸栄養の禁忌として,汎発性腹膜炎,腸閉塞,難治性嘔吐,難治性下痢,腸管虚血などがあげられている.また,このアルゴリズムで注目すべきは栄養補給からの離脱の際の方針も示されているところである.
臨床栄養代謝学会のガイドラインにおいても,「腸が機能している場合は,経腸栄養を選択することを基本とする」とされ,「経腸栄養が不可能な場合や,経腸栄養のみでは必要な栄養量を投与できない場合には,静脈栄養の適応になる」と記載されている(参考文献6-1-2).
関連キーワード
· [3] 静脈栄養[parenteral nutrition]
エネルギー投与量の算出方法
■概論
適切な栄養管理を行ううえで,実際の栄養投与量の決定は良好な栄養状態を維持するために,あるいは目標とする栄養状態にまで改善するために最も重要である.身体の構成成分であるタンパク質,エネルギー源となる糖質,脂質と,この三大栄養素の代謝に深くかかわるビタミン,無機質,水の6種の栄養素についての設定はきわめて重要である.栄養管理中では,患者の病態によって着目すべき指標が異なり,褥瘡や重症感染症などの高度な侵襲下にある患者と,激しい侵襲反応はなく慢性的な栄養摂取障害や代謝障害を主体とした患者に大別でき,前者ではタンパク異化の亢進やエネルギー消費量(EE)の増大が特徴的で短期間での変化を捉えなければならない(参考文献6-2-1).一方,後者では体構成成分(Body Composition)や各機能の維持について長期的な経過を観察することが要求される.
栄養管理におけるエネルギー所要量は,患者のエネルギー消費量,基礎疾患,患者の代謝状態の3つの因子で決定される.したがって,臨床栄養に携わる者は栄養管理を開始する際に栄養学的目標の設定と確実な栄養評価を行う必要がある.
関連キーワード
· [1] エネルギー消費量(EE)[energy expenditure]
各種栄養素の必要量の算出方法
■各種栄養素必要量決定の手順
三大栄養素のタンパク質,脂質,炭水化物の摂取量の決定は,総エネルギー必要量を決めてから,それぞれの栄養素にエネルギー量を分配する方法によって行われる.
まずは,タンパク質の必要量を決定する.平常時のタンパク質必要量は成人で0.8~1.0 g/kg体重/日で,総エネルギー消費量(total energy expenditure:TEE)の10~20%程度である.適切な栄養管理のためには脂質と炭水化物のエネルギーとの割合も考慮する必要がある.この割合を示す指標をNPC/N比(非タンパクカロリー/窒素比)という.タンパク質は,手術や熱傷,感染症などの侵襲期には,その程度に応じて必要量が増す.侵襲の程度に応じて1.2~2.0 g/kg体重/日とする.また,腎不全などでは,病期に応じてタンパク質量を制限する必要がある.タンパク質の1 gあたりの熱量は4 kcalとして,タンパク質のエネルギー量を算出しておく.
タンパク質必要量が決定されれば,次に,脂質必要量を算出する.脂質のエネルギー比率は20~30%程度で設定する.脂質の1 gあたりの熱量を9 kcalとして計算し,必要となる脂質の重量(g)も算出しておく.
最後に,総エネルギー消費量からタンパク質と脂質のエネルギー量を除した,残りのエネルギーを炭水化物に充てる.炭水化物必要量は一般的に総エネルギー必要量の50~60%を基準とする.炭水化物は1
gあたりの熱量を4 kcalとして計算し,必要となる炭水化物の重量(g)も算出しておく.
このようにして三大栄養素の必要量を算出する.
水分必要量は,水分出納から算出するが,実際の臨床では簡便な方法で算出する場合も多い.
多量ミネラル,微量元素(微量ミネラル),ビタミンの必要量は,「日本人の食事摂取基準(2020年版)」や米国静脈経腸栄養学会(ASPEN)のガイドラインなどを参考に決定する.特に,微量元素とビタミンは,「日本人の食事摂取基準(2020年版)」の1日推奨量を基準に投与するのを原則とする.
関連キーワード
· [1] タンパク質必要量の算出[protein requirement]
· [2] NPC/N比(非タンパクカロリー/窒素比)[non-protein calorie/nitrogen]
· [3] 窒素出納の算出[nitrogen balance]
· [4] 脂質必要量の算出[lipid requirement]
· [5] 炭水化物必要量の算出[carbohydrate requirement]
· [6] 水分必要量の算出[water requirement]
· [7] 多量ミネラルの必要量の算出[mineral requirement]
· [8] 微量元素の必要量の算出[trace element requirement]
· [9] ビタミンの必要量の算出[vitamin requirement]
3 SMBGの実際
4 糖尿病の 全身持久力アセスメント
糖尿病
■糖尿病の分類
糖尿病は,インスリン作用の不足に基づく慢性の高血糖状態を主徴とする代謝性疾患であり,糖,脂質,タンパク質を含むほとんどすべての代謝系に異常をきたす(参考文献10-7-1).糖尿病は①1型糖尿病,②2型糖尿病,③その他の特定の機序・疾患によるもの,④妊娠糖尿病の4つに分類される(表Ⅰ).1型糖尿病は,自己免疫機能の異常などにより膵臓ランゲルハンス島β細胞が破壊され,高度のインスリン分泌不全を呈する.2型糖尿病は,インスリン分泌不全にかかわる遺伝的な素因に,インスリン抵抗性に影響するエネルギー過剰摂取,運動不足,肥満,ストレス,加齢などが加わり発症する.

(文献10-7-1より引用)
その他の特定の機序・疾患によるものは,遺伝子異常や他の疾患により引き起こされる糖尿病を指す.
妊娠糖尿病は妊娠中に発症あるいは診断される耐糖能異常である.
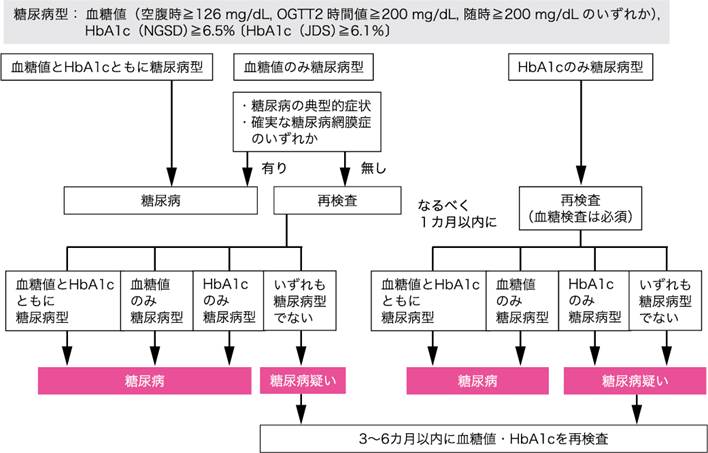
図Ⅰ●糖尿病の臨床診断フローチャート
(文献10-7-1より引用)
■治療方針
糖尿病は,慢性の高血糖状態を確認し,症状・徴候などの臨床所見を考慮して診断する.糖尿病の臨床診断フローチャート(参考文献10-7-1)を図Ⅰに示す.1型糖尿病ではインスリン治療が必須となるが,2型糖尿病では食事療法,運動療法が治療の根幹であり,必要に応じて薬物療法を行う.
合併症の進展抑制には血糖値や血圧などの管理が重要であり,糖尿病の成因,病態,合併症病期を考慮して食事・生活習慣などの適正化を促す必要がある.
A. 食事療法
2型糖尿病の食事療法の目的は,代謝状態を正常に近づけてインスリン分泌不全やインスリン抵抗性を改善し,合併症の発症・進展を抑制することにある.適切な食事療法は,食後血糖値を抑制して薬効を高め,インスリン抵抗性を改善する.摂取エネルギー量は,標準体重に身体活動量を乗じて求める.ただし,最も死亡率の少ないBMIは23~27とする報告もあり,高齢者糖尿病においてはフレイル・サルコペニア予防の観点からの摂取エネルギー量に関するエビデンスの集積が待たれる.
栄養素のバランスは炭水化物50~60%,タンパク質20%,食物繊維20g/日以上を目安に,適量を規則的に食べることが基本である.また,食物繊維を多く含む野菜を先に食べるなど,食べる順番を工夫することもある.1,200 kcal以下の食事では,鉄,クロム,ビタミンなどの微量栄養素不足,それに伴うインスリン感受性低下や過酸化脂質濃度上昇(参考文献10-7-2),(参考文献10-7-3)なども知られており,欠乏症にも注意が必要である.適切な食事療法の実践には,食環境や経済力なども考慮し,調達から食べ方に至る具体的な指導を継続的に行う必要がある.
B. 運動療法
運動療法の目的は,食後高血糖の抑制およびインスリン感受性の改善,骨格筋の維持であり,有酸素運動およびレジスタンストレーニングに加え,バランスや柔軟性を高める運動も組み合わせて行う.導入前に,運動療法が禁忌となるコントロール不良の高血糖や尿ケトン体陽性,および進行した網膜症・腎症の有無,併存疾患,身体機能,栄養状態などを評価し,安全な管理のもとで行う.
C. 薬物療法
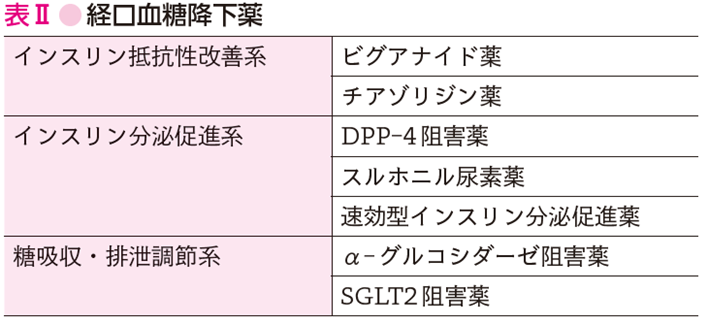
薬物療法を行う際,低血糖の回避に注意を要する.特に高齢者や複数の疾患が重複する場合は,ポリファーマシーによる有害事象のリスク,服薬過誤,服薬アドヒアランス低下などに留意する(参考文献10-7-4).経口血糖降下薬の分類を表Ⅱに示す.
関連キーワード
· [1] インスリン分泌低下とインスリン抵抗性[impairment in insulin secretion and insulin resistance]
· [3] 高齢者糖尿病[older adults with diabetes]
· [5] 高齢者糖尿病におけるフレイル・サルコペニアの予防[frailty, sarcopenia]
肥満
■はじめに
肥満とは,脂肪組織にトリグリセリドが過剰に蓄積した状態である.わが国では体格指数〔BMI=体重(kg)/身長(m)2〕が25以上で肥満と判定される.しかし,肥満は健康障害がなければ疾患とはならない.肥満に起因または関連した健康障害を有し,医学的に減量の必要がある状態,あるいは,内臓脂肪型肥満は現在健康障害を合併していなくとも,将来健康障害を発症するリスクの高い肥満として,「肥満症」と診断する(参考文献10-6-1).
■肥満症の治療方針
治療目標は,内臓脂肪を減少させ,肥満に伴う健康障害を解消あるいは軽減,予防することである.また,内臓脂肪の減少を通じて種々の代謝異常を改善し,動脈硬化性疾患の予防をめざす.わが国ではBMI25未満の非肥満であっても,内臓脂肪蓄積があり,脂質異常,高血圧,高血糖のうち,2つ以上のリスクを有する場合に,メタボリックシンドロームとして治療介入が必要とされている.
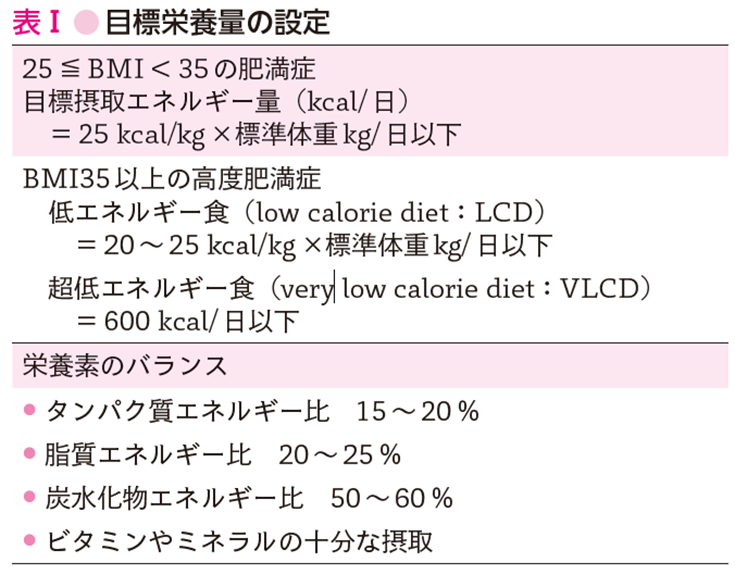
減量では,長期間の継続が困難な目標を設定すべきではない.目標設定のエビデンスとして特定保健指導対象者のうち肥満症の診断基準と合致し,積極的支援を6カ月間行った3,480人の1年後の体重減少と耐糖能異常,脂質異常,高血圧,高尿酸血症,肝機能障害の5種および健康障害との関係を解析した結果が報告されている(参考文献10-6-2).この結果より,BMI35未満の肥満症における減量目標は,3~6カ月で現体重から3%と設定され,2
kg程度の減量であっても健康障害の軽減が期待できる.BMI35以上の高度肥満症患者では,病態に応じて現体重から5~10%の減量を目標とする.日本肥満学会から示されている「肥満症治療指針」を参考にする.
患者自身が問題となる食行動や生活習慣を認識し,個々人にあった食事療法や運動療法に取り組むことが,減量した体重を維持するために必要である.
減量とともに骨格筋量が減少することを防ぐために,運動療法は無理なく体調に合わせて習慣的に行うことが有用である.そのため,レジスタンストレーニングを取り入れることも検討する.減量する際には,体重の評価だけではなく,可能であれば定期的に体組成分析を行い,骨格筋量の評価を行う.
■栄養管理
食事療法は肥満症治療の基本である.体重減少のためには,摂取エネルギーを消費エネルギーよりも少なくする必要がある.誤った食行動や生活習慣,食嗜好を是正し,栄養素のバランスがよい,減量が可能な食事量にする.食事の目標摂取エネルギー量および栄養素のバランスは,表1(参考文献10-6-1)を参考に設定する.
各栄養素の設定は,これまでの個々人の習慣や嗜好によって調整することができる.
① タンパク質
体タンパクの異化亢進を起こさないために,タンパク質は1 g×標準体重kg/日は必要である.
高タンパク質の食事を長期間摂取する安全性は確認されていないため,タンパク質のエネルギー比率は20%を超えないように注意する.
② 脂質
動脈硬化性疾患を予防するために,脂肪摂取は,脂質のエネルギー比率を20~25%にすることが推奨されている(参考文献10-6-3).ただし必須脂肪酸を確保するために,1日20 g以上の脂肪摂取が望ましい.
③ 糖質(炭水化物から食物繊維を除いたもの)
短期間であれば,炭水化物のエネルギー比率を40%まで,個々人の状態に合わせて糖質制限を行うことができる(参考文献10-6-4).
高度肥満症患者(BMI35以上)では,LCD食もしくはVLCD食が選択される.しかし1,000 kcal/日未満の食事では,タンパク質,ビタミン,ミネラルが不足しやすい.タンパク質,ビタミン,ミネラルを含み,エネルギーを低減させたフォーミュラ食(1袋がエネルギー約180 kcal,タンパク質約25 g,ビタミン,ミネラル,微量元素を含んだ粉末状の食品)を利用することは有用である.
長年築いてきた食行動生活習慣,食嗜好から行動変容を起こし,新たに適正な食習慣を一時的に獲得できても,リバウンドを防ぎ長期間減量を維持することは困難であることが多い.患者の気持ちに寄り添った行動療法をとり入れることで,患者が自己管理できるようにする.
(文献10-6-1をもとに作成)
しかし,内科的治療を継続しても十分な効果が得られず,肥満による健康障害が改善しない場合には,肥満外科療法が検討される
関連キーワード
· [1] 内臓脂肪型肥満[visceral fat obesity]
· [2] メタボリックシンドロームの診断基準[metabolic syndrome]
· [3] 行動療法[behavioral therapy]
· [4] 肥満外科療法[bariatric surgery]
脂質異常症
■脂質異常症とは
脂質異常症とは,血液中に含まれる総コレステロール,トリグリセリドなどの血清脂質が基準値を超えて高い状態,もしくはHDLコレステロールなどの血清脂質が基準値よりも低い状態である.脂質異常症は動脈硬化性疾患の危険因子であることから,その治療は狭心症,心筋梗塞,脳梗塞,脳血栓,末梢動脈疾患などの発症,進展予防のために重要である.
日本動脈硬化学会のガイドライン(参考文献10-8-1)では,冠動脈疾患発症予防の観点から脂質異常症の診断基準値が次のように設定されている.空腹時採血にて,LDLコレステロールが140 mg/dL以上のとき高LDLコレステロール血症,120~139 mg/dLのとき境界型高LDLコレステロール血症,またHDLコレステロールが40 mg/dL未満のとき低HDLコレステロール血症,そしてトリグリセリドが150
mg/dL以上のとき高トリグリセリド血症と診断される.
同ガイドラインでは,冠動脈疾患予防からみた管理目標設定のためのフローチャートが示されている.このフローチャートに沿っていくと,糖尿病,慢性腎臓病,非心原性脳梗塞,末梢動脈疾患の主要危険因子がある場合,もしくは追加リスクが重複するに伴ってリスク区分が上がり,リスクに応じて脂質管理目標値が厳しくなる.さらに二次予防ではより厳しい管理目標設定となり,目標値をめざして積極的な治療が行われることとなる.
■脂質異常症とリポタンパク代謝
疎水性の脂質は,血漿中では親水性のタンパク質にとり囲まれて存在しており,このような脂質とタンパク質の結合体をリポタンパクという.中央部分には主にトリグリセリドやコレステロールエステル,その周囲にリン脂質,表層部分にはアポタンパクが存在する.アポタンパクは脂質と結合し,トリグリセリドやコレステロールの転送を助ける.また,リポタンパクと細胞膜の受容体との結合に関与し,リポタンパクリパーゼ(LPL)などリポタンパクの代謝にかかわる酵素の活性を調節する.
リポタンパクには,いろいろな大きさ,重さのものがあり,比重の違いにより大きく4つに分類されている.以下,比重の軽いものから順に示す.
① カイロミクロン
カイロミクロンの90~95%がトリグリセリドで構成されており,主に食事性のトリグリセリドを輸送する.小腸にて吸収された食事由来の脂質は,小腸粘膜上皮細胞にてカイロミクロンに再合成され,リンパ管を経由して血中に入る.
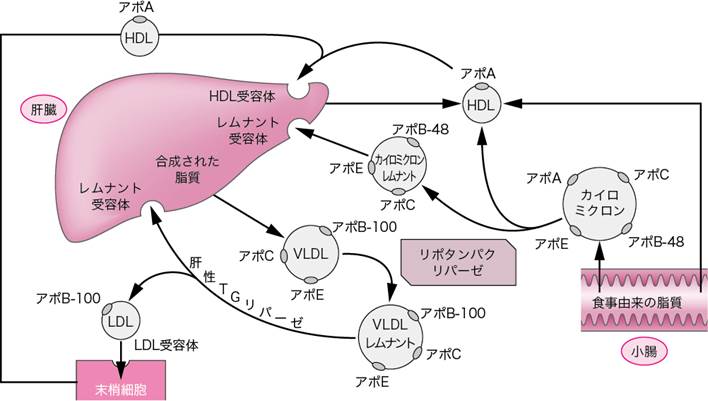
図Ⅰ● リポタンパク代謝
(文献10-8-2をもとに作成)
② 超低密度リポタンパク(very low density
lipoprotein:VLDL)
VLDLの50~65%がトリグリセリドで構成されており,主に糖や脂肪酸から肝臓などで合成された内因性のトリグリセリドを筋肉や脂肪などに輸送する.
③ 低密度リポタンパク(low density
lipoprotein:LDL)
VLDLからトリグリセリドが減少してできる.コレステロールを末梢組織に伝播する.
④ 高密度リポタンパク(high density
lipoprotein:HDL)
肝臓や小腸粘膜上皮細胞でつくられる.末梢組織の余ったコレステロールを引き抜き,肝臓に逆転送する.
リポタンパクは図Ⅰのように代謝される.脂質異常症は,遺伝的素因,運動不足,内臓脂肪型肥満などを原因として,リポタンパクの代謝障害により発症する.
■栄養管理
脂質異常症の治療では,食事療法,運動療法,禁煙など生活習慣の改善とともに薬物療法が考慮される.しかし,すべての脂質異常症患者にとって基本となる治療は生活習慣の改善であり,生活習慣が血清脂質値に大きく関与する.特に食事療法では,エネルギー摂取量の管理による肥満の改善(参考文献10-8-3)や,摂取する脂質の量や質の是正により,脂質代謝の改善に寄与できる.具体的な食事の調整方法は,日本動脈硬化学会の脂質異常症診療ガイド(参考文献10-8-4)にまとめられており参考にする.実際には,それぞれの患者の病態や食習慣,食嗜好などによって対応が必要だが,基本の食事療法は以下のとおりである.
① 総エネルギー摂取量を適正化し,体重を管理する.
総エネルギー摂取量の目標は,標準体重と日常生活活動量から以下の式で算出した量を目安に,現状を踏まえて決定する.
総エネルギー摂取量(kcal/日)= 標準体重×身体活動量
標準体重(kg)=身長(m)×身長(m)×22
身体活動量(kcal/kg):軽い労作25~30,普通の労作30~35,重い労作35~
② 栄養素配分のバランスを考慮する.
エネルギー比率は,脂質は20~25%,炭水化物は50~60%とする.
③ 脂質の質を考慮する.
飽和脂肪酸はエネルギー比率で4.5 %以上7 %未満とし,バター,チーズといった乳製品,肉の脂身,皮など飽和脂肪酸を多く含む食品は摂りすぎないようにする.また,魚油などからn-3系多価不飽和脂肪酸の摂取を増やす.工業由来のトランス脂肪酸を含むマーガリン,ファットスプレッド,ショートニングやこれらを使用した菓子類の摂取は控える.
④ 食物繊維はできるだけ多く摂る.
⑤ 大豆・大豆製品,野菜,糖質含有量の少ない果物を十分に摂る.
⑥ 食塩の摂取は6 g/日未満にする.
⑦ アルコールを控える(1日25 g以下に抑える).
関連キーワード
· [1] 高LDLコレステロール血症[hyper-LDL cholesterolemia]
· [2] 低HDLコレステロール血症[hypo-HDL cholesterolemia]
· [3] 高トリグリセリド血症[hypertriglyceridemia]
· [4] 家族性高コレステロール血症[familial hypercholesterolemia]
高血圧・心血管系疾患
■はじめに
高血圧と心血管系疾患に共通した「食塩摂取制限」は,従来から推奨されてきた代表的な栄養管理である.
日本高血圧学会における降圧目標の原則として,非薬物療法に早めに取り組むことが推奨され,これには食塩摂取制限および肥満をはじめとした生活習慣病対策が重要となる.しかしわが国の急速な高齢化に伴い,フレイルやサルコペニアに加えて低栄養を合併する高血圧患者や心不全患者が増加している.特に心不全患者では,味が濃く食塩量が多い食事を好む傾向にある.食欲が低下している場合は一時的に食塩摂取制限を緩和し,身体機能の維持・改善のため適正な食事摂取量の確保を最優先とすることを推奨するステートメントが2018年に発表されている(参考文献10-9-1).
■高血圧と栄養管理
A. 高血圧の成因
高血圧の成因は遺伝的素因と環境因子に分けられ,食塩の過剰摂取は環境因子のなかでも大きな割合を占める.
食塩が血圧を上昇させる機序は十分に解明されておらず,食塩(ナトリウム)摂取による体液量(細胞外液)の増加が関与していると考えられている(参考文献10-9-2).ナトリウムは浸透圧物質であり,過剰摂取することで血清浸透圧が上昇するため,人体は水分を摂取することで浸透圧の均衡を保とうとする結果,体液量が増え血圧が上昇する.一方,高血圧はその原因により本態性高血圧(原因の明らかでない高血圧)と,二次性高血圧(特定の原因があって発症する高血圧:腎性高血圧,内分泌性高血圧など)の2つに大別される.この本態性高血圧と食塩の関係については多くの臨床介入研究により確認されており,世界32カ国52集団(日本4集団)を対象に血圧と食塩摂取量の関係を調べたINTERSALT研究においても食塩摂取量と血圧は正の相関を示した(参考文献10-9-3).また,減塩による降圧効果も数多くの研究で明らかとされてきたが,その降圧作用には個人差があり,遺伝的素因が大きな影響を与えていると考えられている.
B. 食塩感受性
本態性高血圧患者は,食塩摂取で血圧が上昇しやすい食塩感受性高血圧と,食塩を負荷しても血圧が上昇しない食塩非感受性高血圧の2つのグループに分けられる.この食塩感受性/非感受性の診断については現在,遺伝子レベルでの研究が行われており,血圧の食塩感受性に影響する因子(食塩感受性因子)(参考文献10-9-4)もわかってきた(表Ⅰ).したがって,食塩感受性因子を多くもっている患者ほど減塩による降圧効果は期待できる.
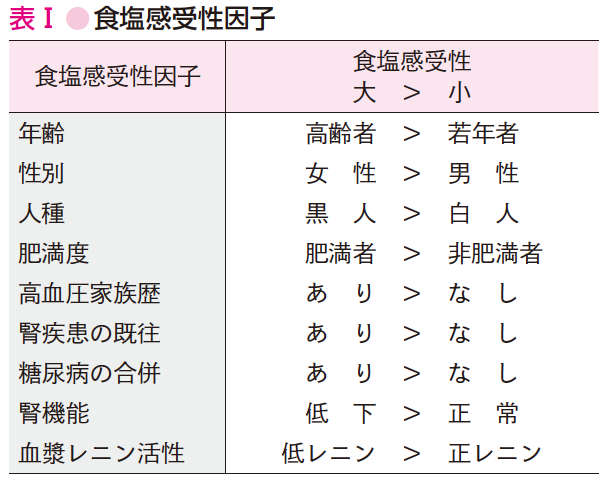
日本人は食塩感受性が高いとされており,また高齢者,メタボリックシンドローム患者などは減塩による降圧効果が大きい.肥満患者が食塩感受性高血圧になりやすい原因として,インスリン抵抗性,高インスリン血症が原因であることも知られている.このインスリンは腎臓でのナトリウム再吸収を亢進させることから,高インスリン血症は食塩感受性高血圧発症に関係する.さらに肥満患者では,脂肪細胞よりアルドステロン(腎臓でのナトリウム再吸収を促進)分泌促進因子が分泌されることで高アルドステロン血症を介して,食塩感受性高血圧になる機序が示唆されている(参考文献10-9-5).
C. 栄養管理
食塩の過剰摂取は,血圧を上昇させて循環器疾患のリスクを高めるが,血圧とは独立して心血管系に悪影響を及ぼすことが明らかとされている.食塩の過剰摂取は脳卒中や虚血性心疾患,心不全の独立した危険因子(参考文献10-9-2)ではあるが,実臨床では食塩摂取制限だけが身体機能やQOL(生活の質)の維持・改善に求められる栄養管理ではないことに注意を払う必要がある(表Ⅱ)注).
注:権利関係の都合により表Ⅱは不掲載となります.書籍にてご参照ください.
■心不全と栄養管理
A. 心不全の経過
心不全が増悪と寛解を反復する経過における全体像と,栄養状態,栄養管理,運動療法の位置づけを図Ⅰ注)に示す(参考文献10-9-1).心不全を発症すると初発症状に対しての治療が開始される.この急性発症期では身体機能は一時的に大きく低下するが,治療により身体機能は改善し,その後は小康状態が継続し,慢性期のステージに移る.そして何らかの原因により心不全の増悪が生じることで,再び身体機能が低下し,増悪と回復を反復するようになる.しだいに治療効果は低下し,身体機能も徐々に低下していく.最終的には難治性の症状を伴うことで緩和ケアが必要な状態となり,身体機能の制限が生じて終末期に移行する.
注:権利関係の都合により図Ⅰは不掲載となります.書籍にてご参照ください.
B. 栄養管理
栄養管理の原則は,まず心不全の原因疾患となる高血圧など生活習慣病対策による急性心不全の発症予防である.発症後は低栄養対策が重要となり,身体機能の維持・改善を図りながら心不全の増悪を予防し,予後の改善をめざすための患者教育が主となる.具体的にはステージAとB,あるいは安定したステージCの段階では栄養状態が保たれていることが多いことから食塩摂取の適正化が主軸となる.心不全の増悪・回復期には,くり返す入退院で徐々に低下する日常生活動作(ADL)やQOL,栄養状態を維持・改善させる栄養管理と運動療法が主役となる.心不全ステージの進行に伴って栄養状態の悪化を認める場合には,適正となるエネルギーやタンパク質摂取の優先度が高くなり,食塩摂取制限により摂取率低下を助長させないことが大切となる.終末期に近づくと,患者の嗜好を優先したQOL向上を図りながら,フレイルやサルコペニアの予防・改善をめざす.
患者個々の心不全ステージに応じ,栄養管理と運動療法の考え方が異なるため,治療方針を多職種で検討し共有することが重要である.
関連キーワード
· [1] 降圧薬と食品[foods influencing antihypertensive drug]
· [2] 抗凝固薬と食品[foods influencing anticoagulant drug]
· [3] 心臓リハビリテーション[cardiac rehabilitation]
高血圧・心血管系疾患
■はじめに
高血圧と心血管系疾患に共通した「食塩摂取制限」は,従来から推奨されてきた代表的な栄養管理である.
日本高血圧学会における降圧目標の原則として,非薬物療法に早めに取り組むことが推奨され,これには食塩摂取制限および肥満をはじめとした生活習慣病対策が重要となる.しかしわが国の急速な高齢化に伴い,フレイルやサルコペニアに加えて低栄養を合併する高血圧患者や心不全患者が増加している.特に心不全患者では,味が濃く食塩量が多い食事を好む傾向にある.食欲が低下している場合は一時的に食塩摂取制限を緩和し,身体機能の維持・改善のため適正な食事摂取量の確保を最優先とすることを推奨するステートメントが2018年に発表されている(参考文献10-9-1).
■高血圧と栄養管理
A. 高血圧の成因
高血圧の成因は遺伝的素因と環境因子に分けられ,食塩の過剰摂取は環境因子のなかでも大きな割合を占める.
食塩が血圧を上昇させる機序は十分に解明されておらず,食塩(ナトリウム)摂取による体液量(細胞外液)の増加が関与していると考えられている(参考文献10-9-2).ナトリウムは浸透圧物質であり,過剰摂取することで血清浸透圧が上昇するため,人体は水分を摂取することで浸透圧の均衡を保とうとする結果,体液量が増え血圧が上昇する.一方,高血圧はその原因により本態性高血圧(原因の明らかでない高血圧)と,二次性高血圧(特定の原因があって発症する高血圧:腎性高血圧,内分泌性高血圧など)の2つに大別される.この本態性高血圧と食塩の関係については多くの臨床介入研究により確認されており,世界32カ国52集団(日本4集団)を対象に血圧と食塩摂取量の関係を調べたINTERSALT研究においても食塩摂取量と血圧は正の相関を示した(参考文献10-9-3).また,減塩による降圧効果も数多くの研究で明らかとされてきたが,その降圧作用には個人差があり,遺伝的素因が大きな影響を与えていると考えられている.
B. 食塩感受性
本態性高血圧患者は,食塩摂取で血圧が上昇しやすい食塩感受性高血圧と,食塩を負荷しても血圧が上昇しない食塩非感受性高血圧の2つのグループに分けられる.この食塩感受性/非感受性の診断については現在,遺伝子レベルでの研究が行われており,血圧の食塩感受性に影響する因子(食塩感受性因子)(参考文献10-9-4)もわかってきた(表Ⅰ).したがって,食塩感受性因子を多くもっている患者ほど減塩による降圧効果は期待できる.
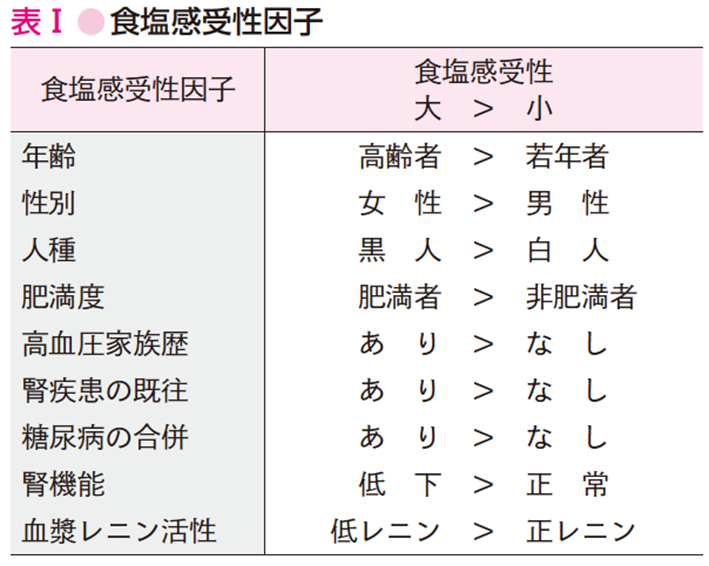
日本人は食塩感受性が高いとされており,また高齢者,メタボリックシンドローム患者などは減塩による降圧効果が大きい.肥満患者が食塩感受性高血圧になりやすい原因として,インスリン抵抗性,高インスリン血症が原因であることも知られている.このインスリンは腎臓でのナトリウム再吸収を亢進させることから,高インスリン血症は食塩感受性高血圧発症に関係する.さらに肥満患者では,脂肪細胞よりアルドステロン(腎臓でのナトリウム再吸収を促進)分泌促進因子が分泌されることで高アルドステロン血症を介して,食塩感受性高血圧になる機序が示唆されている(参考文献10-9-5).
C. 栄養管理
食塩の過剰摂取は,血圧を上昇させて循環器疾患のリスクを高めるが,血圧とは独立して心血管系に悪影響を及ぼすことが明らかとされている.食塩の過剰摂取は脳卒中や虚血性心疾患,心不全の独立した危険因子(参考文献10-9-2)ではあるが,実臨床では食塩摂取制限だけが身体機能やQOL(生活の質)の維持・改善に求められる栄養管理ではないことに注意を払う必要がある(表Ⅱ)注).
注:権利関係の都合により表Ⅱは不掲載となります.書籍にてご参照ください.
■心不全と栄養管理
A. 心不全の経過
心不全が増悪と寛解を反復する経過における全体像と,栄養状態,栄養管理,運動療法の位置づけを図Ⅰ注)に示す(参考文献10-9-1).心不全を発症すると初発症状に対しての治療が開始される.この急性発症期では身体機能は一時的に大きく低下するが,治療により身体機能は改善し,その後は小康状態が継続し,慢性期のステージに移る.そして何らかの原因により心不全の増悪が生じることで,再び身体機能が低下し,増悪と回復を反復するようになる.しだいに治療効果は低下し,身体機能も徐々に低下していく.最終的には難治性の症状を伴うことで緩和ケアが必要な状態となり,身体機能の制限が生じて終末期に移行する.
注:権利関係の都合により図Ⅰは不掲載となります.書籍にてご参照ください.
B. 栄養管理
栄養管理の原則は,まず心不全の原因疾患となる高血圧など生活習慣病対策による急性心不全の発症予防である.発症後は低栄養対策が重要となり,身体機能の維持・改善を図りながら心不全の増悪を予防し,予後の改善をめざすための患者教育が主となる.具体的にはステージAとB,あるいは安定したステージCの段階では栄養状態が保たれていることが多いことから食塩摂取の適正化が主軸となる.心不全の増悪・回復期には,くり返す入退院で徐々に低下する日常生活動作(ADL)やQOL,栄養状態を維持・改善させる栄養管理と運動療法が主役となる.心不全ステージの進行に伴って栄養状態の悪化を認める場合には,適正となるエネルギーやタンパク質摂取の優先度が高くなり,食塩摂取制限により摂取率低下を助長させないことが大切となる.終末期に近づくと,患者の嗜好を優先したQOL向上を図りながら,フレイルやサルコペニアの予防・改善をめざす.
患者個々の心不全ステージに応じ,栄養管理と運動療法の考え方が異なるため,治療方針を多職種で検討し共有することが重要である.
関連キーワード
· [1] 降圧薬と食品[foods influencing antihypertensive drug]
· [2] 抗凝固薬と食品[foods influencing anticoagulant drug]
· [3] 心臓リハビリテーション[cardiac rehabilitation]
肝疾患
■治療方針
A. 急性肝炎・急性肝不全
成因として薬物や自己免疫が考えられる場合を除いて特別な治療は行わず,重症化予知や合併症の予防に努める.薬物性では薬物をすべて中止することを原則とし,自己免疫性にはステロイドを投与する.重症化あるいは劇症化例は専門施設へ搬送し,集中治療を行う.
B. 慢性肝炎・肝硬変(肝がん)
ウイルス性では抗ウイルス療法(DAA療法など)が行われ,ウイルスが駆除できない例には肝炎沈静化の目的でグリチルリチン製剤(強力ネオミノファーゲンシー®,グリチロン®)やウルソデオキシコール酸(ウルソ®)などの肝庇護薬を投与する.C型慢性肝炎では肝内貯蔵鉄が肝炎進展に関与することから,血中フェリチン高値例では瀉血療法と鉄制限食療法の併用が行われる.
肝硬変の代償期では慢性肝炎に準じた薬物治療が,非代償期には肝不全徴候に対する治療が必要となる.腹水・浮腫には塩分摂取制限と利尿薬を投与し,不応例にはアルブミン製剤を輸注する.肝性脳症では便秘などの誘因を除去し,合成二糖類や難吸収性抗菌薬(リファキシミン®)を投与して腸管内アンモニア産生を抑制する.
C. アルコール性肝障害
飲酒習慣の行動変容をめざした指導が基本であり,補助的に肝庇護薬による薬物治療を行う.完全な断酒と栄養障害の是正により症状や検査所見,生命予後の改善がみられることから,本人と家族に断酒の重要性を理解してもらうことが重要である.また,アルコール依存症では,精神科医などの他の医療スタッフと協力することも必要である.
D. 脂肪肝・NASH
飲酒歴がないにもかかわらずアルコール性肝炎に類似した肝組織病変を示す例を非アルコール性脂肪性肝炎(non-alcoholic
steatohepatitis:NASH)とよび,肝硬変や肝がんへの進行がみられることから注目されている.治療の原則は運動と食事療法などの生活習慣の改善であり,体重の7%以上の減量が達成されれば,肝酵素や肝組織像が改善することが示唆されている.急激な体重減少は病態を増悪させることがあることから,2~3 kg/月程度の緩徐な体重減量を目標とする.薬物療法としては,インスリン抵抗性改善薬(チアゾリジン誘導体,ビグアナイド剤)や抗酸化療法(ビタミンE)などが試みられている.高度肥満例(BMI≧35)で,高血圧,糖尿病,脂質異常症のいずれかを有する場合には,腹腔鏡下スリーブ状胃切除術(縫縮術)などの外科的治療を考慮する.
■栄養管理
栄養療法は肝疾患治療の基本であり,三大栄養素だけでなくビタミンやミネラルにも配慮し,さまざまな食材を偏りなく用いた食事をとることが理想である.患者をとり巻く環境はさまざまであり,必ずしも理想どおりにはいかないことも多いが,薬物療法のみに目を奪われることなく,個々の患者の食事摂取調査をもとに栄養指導を行うことが大切である.
A. 急性肝炎・急性肝不全
基本的には経腸栄養を選択し,食欲低下がみられる場合のみグルコースを中心とする末梢輸液を行う.肝予備能が著しく低下している急性期には絶食として中心静脈栄養(TPN)を行うのが一般的である.急性期は 25 kcal/kg体重/日または間接熱量測定,Harris-Benedictの式から求めた安静時エネルギー消費量の1.2~1.4倍に相当するエネルギー量を投与することが多い.輸液の組成はグルコースと電解質を基本とし,必要に応じてインスリンの併用やビタミン・ミネラルの補充を行う.
急性期におけるアミノ酸・脂肪輸液の使用の是非については一定の見解が得られていないが,回復期には肝再生時のアミノ酸需要の観点から,昏睡度や肝予備能(プロトロンビン時間やアンモニア)の改善をみて分岐鎖アミノ酸療法を併用する.
B. 慢性肝炎・肝硬変(肝がん)(図Ⅰ)
肝予防能,肝性脳症や耐糖能異常の有無,身体計測,年齢,食習慣調査などを参考にして栄養治療計画を立てる.慢性肝炎および肝硬変代償期には,欧州静脈経腸栄養学会(ESPEN)のガイドライン(タンパク:1.2~1.5 g/kg,総エネルギー30~35 kcal/kg)などに準じたバランスのとれた食事療法を行うことが一般的で1),エネルギー低栄養では就寝前補食療法(LES)が推奨されている.食道・胃静脈瘤などの消化管出血がある例や脳症極期では経口摂取が困難なことから,経静脈栄養により分岐鎖アミノ酸高含有輸液(アミノレバン®,モリヘパミン®)の投与を行う.覚醒後に蛋白不耐症を認める場合には経腸栄養剤(アミノレバン®EN,へパンED®),BCAA顆粒(リーバクト®)などの分岐鎖アミノ酸療法を併用する.また,亜鉛欠乏やカルニチン欠乏を伴う肝性脳症には,亜鉛製剤(ノベルジン®)やカルニチン製剤(エルカルチン®FF)の併用を考慮する.腹水・浮腫例では,食塩摂取量を5~7 g/日程度に制限する必要がある.
C. アルコール性肝障害
アルコール依存症では,食事をほとんど摂取せずに飲酒し,低栄養状態に陥っている患者が多い.断酒指導とともに高タンパク・高エネルギー食(タンパク:1.2~1.5 g/kg,総エネルギー30~35 kcal/kg)により栄養是正に努める.ビタミンB1不足によるWernicke脳症や多発神経炎,ビタミンB12不足による大球性貧血や末梢神経炎を起こす例もあり,ビタミンB群を中心としたビタミン剤の補充を行う.近年,肝障害の進展因子として肥満が注目されており,糖尿病や肥満合併例では,栄養過多に対する食事(タンパク:1.0~1.2 g/kg,脂質/エネルギー比:20~25%程度,総エネルギー:25~30 kcal/kg)を指導する必要がある.
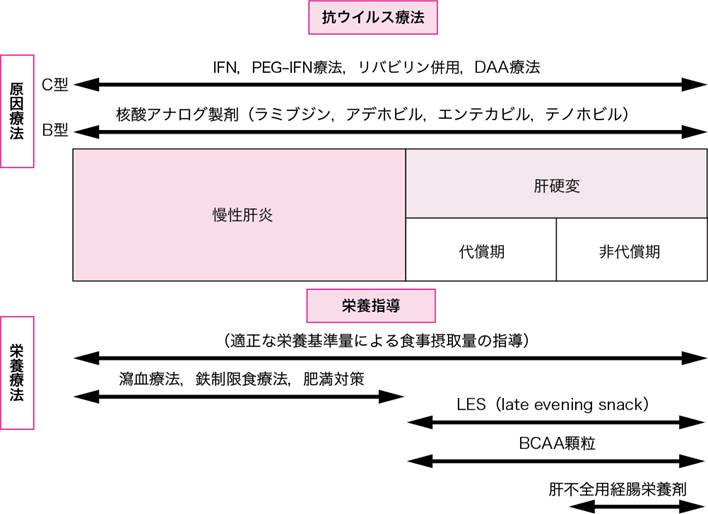
図Ⅰ●原因療法と栄養療法のポジショニング
DAA:direct acting antiviral
D. 脂肪肝・NASH
糖尿病例に対する食事療法に準じ,標準体重あたり25~30
kcal/日,炭水化物/エネルギー比率50~60%,脂質/エネルギー比20~25%程度の食事を基準とし,節酒を継続する.脂質に関しては,飽和脂肪酸の過剰摂取は血中コレステロールを上昇させることから,バター・牛乳・獣肉類を制限する.
しかし一方で,極端な脂肪制限は脂溶性ビタミンの不足につながるため注意を要する.
関連キーワード
· [1] 鉄制限食療法[iron restriction diet therapy]
· [2] 分岐鎖アミノ酸療法[branched-chain amino acid treatment]
· [3] 就寝前補食療法(LES)[late evening snack]
· [4] 蛋白不耐症[protein intolerance]
呼吸不全と慢性閉塞性肺疾患(COPD)
■呼吸不全と栄養障害
慢性呼吸不全(呼吸不全)を呈する主な基礎疾患として,慢性閉塞性肺疾患(chronic obstructive pulmonary disease:COPD),肺結核後遺症,間質性肺疾患などがあげられる.COPD患者では肺結核後遺症や間質性肺疾患と比較し高率に体重減少が認められる.肺結核後遺症では,呼吸不全症例で体重減少が高度であるが,COPDでは呼吸不全に陥る以前から特徴的かつ高率な栄養障害が認められる.わが国の外来受診患者の約30%でBMIが20 kg/m2未満の体重減少が認められ,Ⅲ期(重症)以上では約40%,Ⅳ期(最重症)では約60%と重症ほど高率な体重減少が認められる(参考文献10-15-1).一方,軽症ないし中等症患者では体重減少が重症度とは独立した予後因子となる.
■COPDにおける栄養障害
A. 栄養状態
日本呼吸器学会によるCOPD診断と治療のためのガイドライン第5版(参考文献10-15-2)では推奨される栄養評価項目を必須の項目,行うことが望ましい項目および可能であれば行う項目として段階的に記載している(表Ⅰ)注).
COPD患者では年齢をマッチさせた健常対照と比較し,体重などの身体計測値はすべて低下しており,体成分分析ではfat
mass(FM),fat-free mass(FFM)がともに減少している.FMの減少は軽度の体重減少(80%≦%IBW<90%)から認められ,FFMと骨塩量の減少は中等度以上の体重減少(%IBW<80%)で明らかとなる(参考文献10-15-1).簡易栄養状態評価表(Mini Nutritional Assessment Short-form:MNA®-SF)は急性増悪の予測因子にもなる(参考文献10-15-3).
内臓タンパクでは血清アルブミンの減少例は少ないが,血清プレアルブミン,レチノール結合タンパクなどのrapid
turnover protein(RTP)が減少し,血漿アミノ酸分析では,分岐鎖アミノ酸(BCAA)の減少によるBCAA/芳香族アミノ酸(AAA)比の低下を認める.
注:権利関係の都合により表Ⅰは不掲載となります.書籍にてご参照ください.
B. 栄養障害の機序
COPD患者では安定期においても,安静時エネルギー消費量(resting
energy expenditure:REE)の増大に反映される代謝亢進が認められ,栄養障害の主因と考えられる(参考文献10-15-1).
REEの増大は主として,閉塞性換気障害や肺過膨張などによる呼吸筋酸素消費量の増大に基づいている(図Ⅰ).重症化に伴う食事摂取量の減少がエネルギーインバランスを惹起し,レプチンや炎症性サイトカインが摂食抑制因子として関与することも示唆されている.また,摂食促進因子であるグレリンの血中濃度は栄養障害の進行に伴い上昇するが,十分な代償効果は得られない(参考文献10-15-1).この場合,エネルギー源として脂肪とともに筋タンパクも利用され筋量は減少する.その結果,呼吸筋力や換気効率が低下し,さらなるREEの増大要因となる.
加えて異化因子である炎症性サイトカインやノルエピネフリンの血中濃度が,成長ホルモンやインスリン様成長因子-1(insulin-like growth factor-1:IGF-1)などの同化因子に対して優位となっている.このような複合的な要因が関与して“pulmonary cachexia”といわれる特徴的なタンパク・エネルギー栄養障害が惹起される.
COPD患者では血中のTNF-α(tumor necrosis factor-α)やIL-6(interleukin-6)などの炎症性サイトカインやhs-CRP(高感度C-反応性タンパク)の上昇に反映される全身性炎症が栄養障害をはじめとするさまざまな全身の併存症の発症要因となっている(参考文献10-15-2).
C. COPDとサルコペニア
FFMの減少により呼吸筋力や運動耐容能は低下し,健康関連QOL(health-related quality of life:HRQOL)の悪化につながる.さらに,FFMは体重よりも特異性の高い予後因子となることが知られている.
サルコペニアとは,「筋量と筋力の進行性かつ全身性の減少に特徴づけられる症候群で,身体機能障害,QOL低下,死のリスクを伴うもの」と定義されている(参考文献10-15-4).
これまでCOPDにおいてFFMの減少として捉えてきた病態を今後はサルコペニアという疾患概念から解釈していく必要がある.海外ではCOPDにおけるサルコペニアの合併頻度は約15~30%と報告されており,高齢かつ気流閉塞が重症であるほど合併率が高い(参考文献10-15-5).
高齢者COPD患者が多いわが国では海外よりも高率であると推測されるが実態は明らかではない.
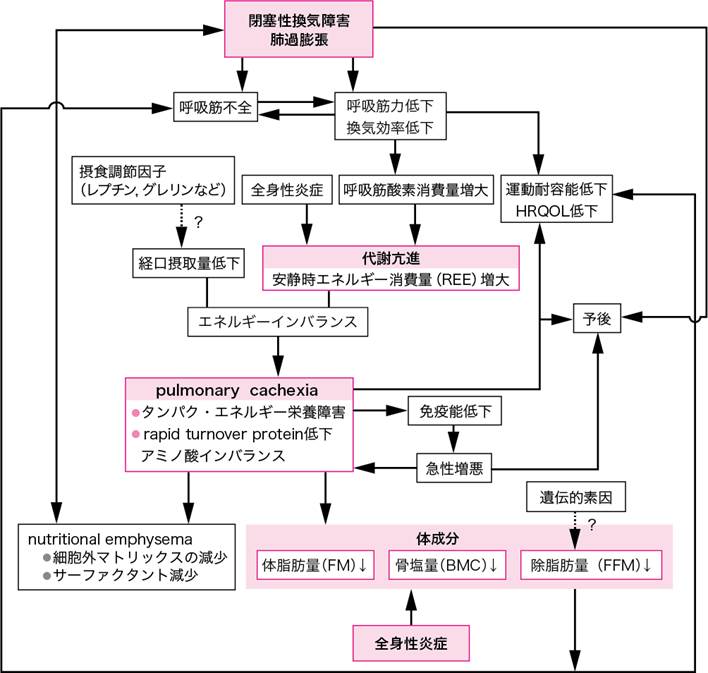
図Ⅰ●COPDの栄養障害と病態との関連
サルコペニアは運動耐容能や身体活動性の低下,骨粗鬆症(参考文献10-15-6),予後の悪化と関連しており,栄養管理としてサルコペニア対策を重視すべきである.FM,FFM,骨塩量などの体成分の変化と画像所見に基づき分類したメタボリックフェノタイプが提唱されている(参考文献10-15-7).Cachexia(気腫型)は筋萎縮,骨粗鬆症,脂肪量の減少を伴い,Obesity(非気腫型)は皮下・内臓脂肪の増加,動脈硬化病変と心血管疾患のリスクを伴い,Sarcopenic obesity(病型と関連なし)は筋萎縮,内臓脂肪増加,動脈硬化と心血管疾患のリスクを伴う.COPDの栄養療法においては,これらのフェノタイプを考慮した個別化治療が求められつつある.
D. COPDの栄養治療
COPD患者は安定期には外来で管理されており,栄養治療は食事指導と経口栄養補給療法が中心となる.エネルギーや栄養素の摂取量が不足している場合は是正を行う.高エネルギー,高タンパク食の指導が基本であり,投与エネルギー量は実測REE の約 1.5 倍,基礎代謝量の約1.7倍を目標とする(参考文献10-15-1).タンパク源としてはBCAAの含有量が多い食品が勧められる.脂肪はエネルギー効率が高いため,可能な限り摂取する.体重や食事内容の目標を設定し,体重や食行動を記録するself-monitoring も有用である.栄養指導における行動療法では,栄養士,医師,看護師などが参加したチーム医療が望ましい.
図Ⅱ● 経口栄養補給療法における経腸栄養剤の選択
食事摂取量を増やすことが困難な場合や,中等度以上の体重減少が認められる場合には,経腸栄養剤や栄養補助食品による栄養補給療法を考慮する(図Ⅱ).経腸栄養剤はエネルギー源が炭水化物主体と脂肪主体の栄養剤に大別される.総エネルギーが過量でなければ,炭酸ガス産生量には差がないため,著しい換気不全がなければ,十分なエネルギー摂取を優先させる.筋タンパクの異化抑制やタンパク合成促進を目的としたBCAA強化栄養剤や,全身性炎症の制御をめざしたn-3系脂肪酸強化栄養剤やカルニチン,ホエイペプチド含有栄養剤などの有効性が示されている.BCAAのなかでも,ロイシンはタンパク合成を制御しているmTOR(mammalian target of rapamycin)を活性化することにより筋タンパク合成への強いシグナルとなっている.近年では,ロイシンの中間代謝物であり,mTORをより特異的に活性化するβ-ヒドロキシ-β-メチル酪酸(HMB)含有栄養剤の有効性も注目されている.オクタン酸の含有量が多い栄養剤では,摂食促進作用のあるグレリンの血中レベルの上昇が報告されている.
栄養補給療法を単独で施行した場合の有効性は限定的であり,運動療法の併用が推奨されている(参考文献10-15-8).しかし,サルコペニアを伴うCOPD患者における高強度の運動療法は全身性炎症を増強し異化作用に働くことが示唆されている.一方,適切な強度による運動療法は全身性炎症を抑制し,骨格筋タンパクの維持や栄養障害の対策として有効と考えられる.低強度運動療法と栄養療法のコンビネーションセラピーが最も有効なサルコペニア対策である.タンパク同化作用と抗炎症作用を有する栄養素材の併用が注目される.
■急性呼吸不全の栄養治療
慢性呼吸不全の急性増悪や急性呼吸窮迫症候群(acute
respiratory distress syndrome:ARDS)などに代表される急性呼吸不全では,肺の障害だけではなく全身の消耗を伴い,積極的な栄養管理が必要となる.また,栄養状態は人工呼吸器からの離脱の成否において重要な規定因子となる.
このような病態の場合は,静脈栄養より可及的すみやかな経腸栄養の開始が勧められる.経腸栄養剤のエネルギー量については結論が得られていないが,早期に25 kcal/kg体重/日以上の投与を推奨する根拠はなく,500 kcal/日程度の少量経腸栄養に対する強い反対根拠はない(参考文献10-15-9).
高脂肪組成栄養剤(プルモケア®)は,脂質の呼吸商が低値のため動脈血炭酸ガス分圧の上昇を防ぎ,1.5 kcal/mLと高エネルギーであるため水分負荷を回避できる.しかし,その臨床的効果は十分には検討されていないため,ASPENのガイドラインにおいては推奨されていない(参考文献10-15-10).
ARDSではアラキドン酸の代謝物であるプロスタグランジンやロイコトリエンなどの炎症性メディエーターの増加が急性肺障害に関与している.さらにIL-1,IL-6,IL-8などの炎症性サイトカインによって異化亢進が惹起される.このような病態に対してn-3系脂肪酸(主としてエイコサペンタエン酸)やγ-リノレン酸,抗酸化ビタミン類を強化したオキシーパ®の有効性が検討されている.オキシーパ®は臨床的には肺酸素化能の改善,人工呼吸日数の短縮や死亡率の改善をもたらし,早期投与が支持される可能性があるが,現時点で一定した有効性は確立されていない(参考文献10-15-9).
関連キーワード
· [1] 呼吸不全[respiratory failure]
· [2] 慢性閉塞性肺疾患(COPD)[chronic obstructive pulmonary disease]
· [3] COPDの全身への影響[systemic effects]
· [4] COPDにおける代謝亢進[hypermetabolism]
· [5] COPDの全身性炎症[systemic inflammation]
脳卒中
■治療方針
脳卒中診療のポイントは,①CT・MRIの24時間稼働,②rt-PA(アルテプラーゼ)静注療法(発症4.5時間以内の血栓溶解療法),③外科治療,④血管内治療(機械的血栓回収療法など),⑤臨床病型に応じた内科治療,⑥入院当日から二次予防開始,⑦早期離床・早期リハビリテーション(以下リハ),⑧感染対策,⑨栄養管理,の9項目である.これらを多科・多職種によるチーム医療で実践するために脳卒中専門病棟(stroke unit)(参考文献10-10-1)を立ち上げてクリティカルパス(参考文献10-10-2)を活用する.
意識レベル,呼吸(数,深さ,型),循環(血圧,脈拍),体温などのバイタルサインのチェック,パルスオキシメーターによる酸素飽和度測定あるいは動脈血液ガス測定,全血算,血液生化学検査,検尿,心電図などのデータをもとに血圧管理,循環管理,呼吸管理(低酸素血症の是正),血糖管理(高血糖の是正),体温管理(高体温の改善),電解質管理,栄養管理などの全身管理を行う(表Ⅰ).
くも膜下出血や脳出血では外科治療の適応を即座に判断する.脳梗塞ではrt-PA(アルテプラーゼ)静注療法や機械的血栓回収療法(2018年に発症から24時間まで治療域が拡大)の適応を即座に判断し,その後は抗血栓療法を主軸に脳保護療法や抗脳浮腫療法を併用する.
抗血栓療法では注射薬による急性期治療とともに,入院当日や翌日から内服薬による二次予防を開始するため意識障害や嚥下障害の症例では経鼻胃管を挿入する.

■栄養管理
脳卒中患者は,意識障害,嚥下障害や運動障害,症候進行症例,感染症の併発,脳浮腫(頭蓋内圧亢進による嘔吐),手術必要例,認知症の合併,脳卒中に伴う消化器合併症,抗血栓療法に伴う消化管出血の併発,などの多くの問題がある.さらに高血圧,糖尿病,脂質異常症を合併している場合が多く,特に糖尿病合併例ではネフローゼ症候群を合併することもある.これらの基礎疾患も考慮して栄養管理を行わなければならず,たいへん苦労することが多い.
疾患にかかわらず,原則入院36時間以内に経腸栄養を開始する必要があるため,当院では独自に作成した嚥下障害アルゴリズムに従い栄養評価を行い,入院当日あるいは入院翌日までに栄養手段・内容が決定される(図Ⅰ).
経口摂取ができない場合には経管栄養を入院翌日に可能な限り開始する.嚥下が可能になってきたら経口訓練食を開始する.
ワルファリンが開始された場合には,ワルファリン食を選択する.2011年からは納豆を食べることができて,薬物相互作用の少ない直接作用型経口抗凝固薬(direct oral anticoagulant:DOAC)が登場したいへん便利になっている.なお栄養管理の目標は経口摂取であり,安易な内視鏡的胃瘻造設は慎むべきである.
脳卒中では誤嚥性肺炎に代表される嚥下性肺疾患を併発することが多い.感染症を併発したときほど栄養の増量が必要であるが,多くの症例ではすぐに絶食となり,抗菌薬の投与とともにTPNが開始されることが多く,MRSA腸炎や偽膜性腸炎を併発してくる.
可能な限り経腸栄養を続行し,絶食にしなければならない場合にはGFO療法を行う.また,普段から嚥下性肺疾患を併発しないように口腔ケアを行うことが重要である.
図Ⅰ●嚥下障害アルゴリズム
JCS:Japan coma scale(日本昏睡尺度)
関連キーワード
· [2] 脳卒中クリティカルパス[critical pathway]
· [4] 直接作用型経口抗凝固薬(DOAC)[direct oral anticoagulant]
· [5] 嚥下性肺疾患[swallowing-induced lung disease]
· [7] 脳梗塞患者の口腔ケア(口腔内清掃)[oral care]
がん
■はじめに
がんの栄養管理といっても非常に幅広い病態における栄養管理を述べなければならない.したがって,がん種別の解説は成書を参照いただくこととして,がんの総論的な栄養に関するキーワードおよび,各論的なキーワードをあげ,がん栄養療法において有用な栄養素について論じたい.
■がんと炎症
がんと炎症は密接な関係にあり,炎症の進行は患者のquality of life(QOL)を悪化させる.その理由には2つあり,①がん治療による炎症と②がんの代謝による炎症である(図Ⅰ).
A. がん治療による炎症
がん治療は常に炎症を惹起する行為である.つまり,手術はがんのみを切除する行為でなく,正常組織にメスを入れ,がんに到達することで癌腫を取り除くので,正常組織が侵襲を受け炎症反応が惹起される.抗がん剤は腸管粘膜の萎縮をきたすことで,結果的に腸管内のバクテリアルトランスロケーションやエンドトキシントランスロケーション(血液循環やリンパ流への流入を許してしまうこと)で炎症を惹起する(参考文献10-16-1).これらの多くの副作用発現時には絶食となることが多い.これらの副作用を最小限に留めるために腸管を使った栄養剤に注目が集まっている.動物実験では,経腸栄養管理を行うことで抗がん剤による粘膜障害を予防することが可能であるという結果が得られている.今後,がん治療における栄養療法による副作用コントロールが重要な課題となるだろう.
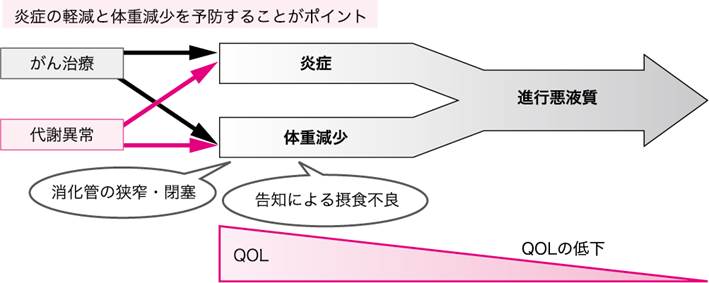
図Ⅰ●QOLの維持には,より早期からの対処が重要
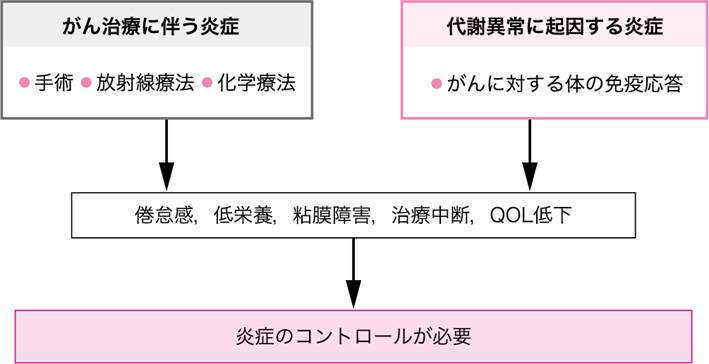
図Ⅱ●がん患者における炎症と症状,治療への影響
B. がんの代謝による炎症
担がん状態であるということは,がん細胞と仲良く共存するということが肝要である.つまり,がんを身体の中から追い出すことは必ずしも容易ではなく,おとなしくしているがんと上手に暮らすことが求められる.それにはがんの細胞の性質を知ることが肝要である.がん細胞と周囲の組織はがん細胞に反応して常に炎症性サイトカインを放出しており,炎症を惹起している.炎症性サイトカインの放出はがんが進行するにつれ増加し,サイトカイン・ストームという状態に至り,細胞の水分調整を乱し,やがては胸水,腹水貯留,全身浮腫,肺水腫などの病態を伴うがん悪液質に至る.担がん状態=慢性炎症といっても過言ではないので,この慢性炎症の悪化を防ぐことはがんと仲良く暮らすヒントになると思われる.
栄養と炎症は密接な関係にある.炎症をコントロールするための栄養の研究が多くなされてきた.今後はがんと共存することや,治療を完遂することを目的とした炎症のコントロールに栄養を用いることに注目が集まると思われる(図Ⅱ).
■がんによる体重減少
がんになると痩せる.それは一般的な概念としても知られている.痩せるがん=消化器系のがんのみと考えられてきたが,肺がんや前立腺がんでも体重減少が生じる(図Ⅲ).がんで痩せる理由には2つあり,1つが当然のことながら,食べ物の通り道である咽頭喉頭や消化管ががんによって占拠される.これは手術や化学療法によって,通過を回復する以外には治療方法はない.
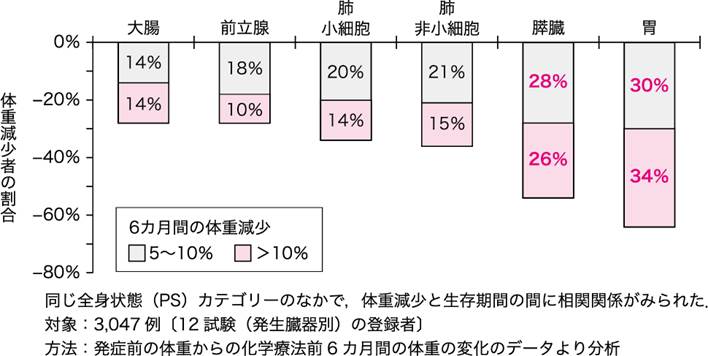
図Ⅲ●部位別がんの体重減少の頻度
多くのがん種で体重減少がみられる
(文献10-16-2より引用)
2つめはがん細胞自身が放出するlipid mobilizing factor (LPM),
proteolysis-inducing factor (PIF)という物質が脂肪や筋肉を減少させるためである.特にがん患者ではPIFによる筋肉の減少が何となく元気がなさそうに見える原因である.
■がんと栄養
がんの栄養代謝を理解することは,食欲不振悪液質症候群の状態に対する理解が深まることであり,臨床的に重要である.悪液質そのものが多因子的な原因をもつために,悪液質に対する治療も多面的なアプローチが必要となる.治療として,NST的な栄養介入,プロゲステロン製剤などによる薬物療法も重要であり,同時に,EPAや抗サイトカイン抗体など,悪液質に対する効果が期待される発展途上な治療法も多数あり,今後の研究結果が待たれる.また,いったん完成された悪液質の治療は困難であり,やはり,その前段階での介入や治療が今後重要となってくるであろう.すなわち,がんと診断されたその日から栄養療法を考える必要があると思われる.
発がんに関係する栄養素の研究も盛んで,発がんと脂肪酸の関係もひとつのトピックとしてあげられる.
関連キーワード
· [1] 炎症をコントロールする栄養[immune control nutrition]
· [2] 腸管内バクテリアルトランスロケーション,エンドトキシントランスロケーション[intestinal bacterial/ endotoxin translocation]
· [4] がんと炎症性サイトカイン[proinflammatory cytokine]
· [5] LPM, PIF[lipid mobilizing factor, proteolysis-inducing factor]
· [6] 食欲不振[cancer induced appetite loss]
· [7] がん患者の代謝[metabolic status of cancer patients]
· [8] がん悪液質の治療[therapeutic approach for cancer cachexia]
· [9] 発がんと脂肪酸[fatty acid and carcinogenesis]
· [10] 化学療法による副作用[side effects from chemotherapy]
· [11] 放射線療法による副作用[side effects from radiotherapy]
· [13] がん治療による悪心・嘔吐[nausea/vomiting]
· [14] がん治療による味覚変化・嗅覚変化[change of gustation and olfaction]
リハビリテーションと栄養
■リハビリテーション栄養
リハビリテーション(以下,リハ)栄養とは,国際生活機能分類(International Classification of Functioning, Disability and Health:ICF)による全人的評価と栄養障害・サルコペニア・栄養素摂取の過不足の有無と原因の評価,診断,ゴール設定を行ったうえで,障害者やフレイル高齢者の栄養状態・サルコペニア・栄養素摂取・フレイルを改善し,機能・活動・参加,QOLを最大限高める「リハからみた栄養管理」や「栄養からみたリハ」である(参考文献10-17-1).リハを要する入院患者の約50%に,低栄養やサルコペニアを認める.また,低栄養やサルコペニアがある場合には,サルコペニアの摂食嚥下障害を生じやすく,リハを行っても機能回復が悪く,死亡率が高い.そのため,リハを要する患者には機能訓練だけでなく,低栄養やサルコペニアを診断して改善することが重要である.しかし実際には,病院・施設で医原性低栄養や医原性サルコペニアがつくられることがあり,生活機能やQOLを低下させている.そのため,質の高いリハ栄養の実践が求められる.
■リハビリテーション栄養ケアプロセス
質の高いリハ栄養実践のために,リハ栄養ケアプロセスというマネジメントサイクルを開発した1).リハ栄養ケアプロセスは,①リハ栄養アセスメント・診断推論,②リハ栄養診断,③リハ栄養ゴール設定,④リハ栄養介入,⑤リハ栄養モニタリングの5段階で構成される(図Ⅰ)(参考文献10-17-2).従来の栄養ケアマネジメントとの違いは,②リハ栄養診断と③リハ栄養ゴール設定という段階の明確化である.従来の栄養ケアマネジメントでは,栄養スクリーニング,栄養アセスメントの後に,栄養ケアプランの立案を行っていた.しかし,低栄養やサルコペニアの原因を詳細に考えずに,またリハと栄養状態の具体的なゴールを設定せずに,質の高い栄養ケアプランを立案することは難しい.また,アメリカ栄養士会が開発した栄養ケアプロセスには,リハ栄養では欠かせないサルコペニアが含まれていない.そのため,質の高いリハ栄養の実践には,栄養ケアプロセスでは不十分である.
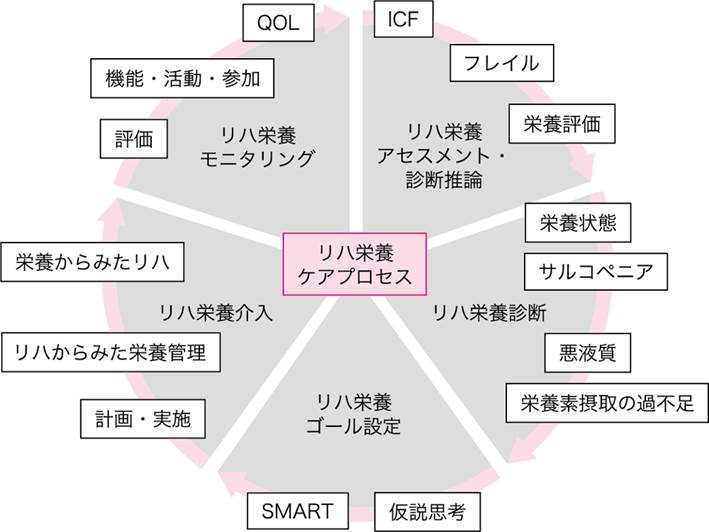
図Ⅰ●リハビリテーション栄養ケアプロセス
(文献10-17-2より引用)
■リハビリテーション栄養診療ガイドライン
日本リハビリテーション栄養学会では,質の高いリハ栄養実践のために,脳血管疾患(参考文献10-17-3),大腿骨近位部骨折(参考文献10-17-4),成人がん(参考文献10-17-5),急性疾患(参考文献10-17-6)の4疾患についてリハ栄養診療ガイドライン2018年版を作成した.各疾患のクリニカルクエスチョン(CQ)とステートメントは,以下の通りである.
A. 脳血管疾患
【CQ】リハを実施されている高齢の脳血管疾患患者に,強化型栄養療法は行うべきか?
【推奨】リハを実施されている急性期の高齢の脳血管疾患患者において,死亡率,感染の合併症を減らし,QOLを向上する目的に,強化型栄養療法を行うことを弱く推奨する(弱い推奨/エビデンスの確実性:低い).
B. 大腿骨近位部骨折
【CQ】リハを実施している65歳以上の大腿骨近位部骨折患者に,強化型栄養療法を行うべきか?
【推奨】リハを実施している65歳以上の大腿骨近位部骨折の患者において,死亡率および合併症発症率の低下やADLおよび筋力の改善を目的として,術後早期からのリハと併用して強化型栄養療法を行うことを弱く推奨する(弱い推奨/エビデンスの確実性:低い).
C. 成人がん
【CQ】不応性悪液質を除く成人がん患者にリハと栄養指導を組み合わせたプログラムを行うべきか?
【推奨】補助化学療法または放射線療法を行う成人がん患者に対して,リハと栄養指導を組み合わせたプログラムを行うことについて一律・一定の推奨はしないこととする(エビデンスの確実性:非常に低い).
ただし患者および家族の意向と病状を勘案し,リハと栄養指導の必要性を個別に判断することが望ましい.低栄養や悪液質を有し,ADL低下を認める成人がん患者に対するリハと強化型栄養療法の組み合わせ効果については現時点でエビデンスが存在せず特定の推奨を行うことはできない.
D. 急性疾患
【CQ】不応性悪液質を除く成人がん患者にリハと栄養指導を組み合わせたプログラムを行うべきか?
【推奨】補助化学療法または放射線療法を行う成人がん患者に対して,リハと栄養指導を組み合わせたプログラムを行うことについて一律・一定の推奨はしないこととする(エビデンスの確実性:非常に低い).
ただし患者および家族の意向と病状を勘案し,リハと栄養指導の必要性を個別に判断することが望ましい.低栄養や悪液質を有し,ADL低下を認める成人がん患者に対するリハと強化型栄養療法の組み合わせ効果については現時点でエビデンスが存在せず特定の推奨を行うことはできない.
関連キーワード
· [1] 医原性サルコペニア[iatrogenic sarcopenia]
· [2] サルコペニアの摂食嚥下障害[sarcopenic dysphagia]
· [3] リハビリテーション栄養診断[rehabilitation nutrition diagnosis]
· [4] リハビリテーション栄養ゴール設定[rehabilitation nutrition goal setting]
· [5] リハ栄養における活動係数[activity index in rehabilitation nutrition]
· [6] 攻めの栄養管理[aggressive nutrition care management]
· [7] 肥満パラドックス[obesity paradox]
· [8] リハビリテーション薬剤[rehabilitation pharmacotherapy]
内部機能系理学療法治療学演習
1 がん 肥満症 サルコペニア 動脈硬化症 慢性腎臓病 最も頻出な疾患 糖尿病 疫学 主症状 合併症 代謝機能の定義 フィジカルアセスメント
2 理学療法と病態コントロール
3 各疾患に対するADL
4 各疾患に対する理学療法の実際
5 各疾患に対する理学療法の実際演習
在宅医療の現状と栄養管理
■はじめに
在宅での自立した生活を維持するためには,十分なエネルギーと水分を摂取することが必要である.しかしながら,低栄養状態の高齢者も少なくはなく,在宅での栄養管理が周知できていない現状がある.また,エネルギーと水分だけでなく重要な栄養素がいくつかある.例えば,腎機能が保たれている高齢者については,体内で合成することができない必須アミノ酸の補給が,筋肉合成にとっても必要となる.人生の最終段階における緩和治療として,コラーゲンペプチドは,皮膚トラブルの改善に有用とされている.中鎖脂肪酸は腸管で吸収され肝臓にてケトン体を産生する.ケトン体はグルコースに代わって脳のエネルギー源となってくれるため,認知症の改善に効果があると注目を浴びている.生薬ではあるが,六君子湯はグレリンの分泌を高め,食欲増進効果があるとされている.
また,枯れるように逝くことが人の最期の1つのかたちとして認知されつつあり,人生の最終段階の人工的水分・栄養補給法(artificial hydration and nutrition:AHN)による栄養療法のあり方についても議論されている.AHNの代表格である胃瘻は,延命治療の代名詞のような扱いを受けていることが危惧される.延命治療を受けたいか受けたくないかの選択肢ではなく,人生の最終段階において栄養療法がその人にとって益なのか害なのかをチーム〔栄養サポートチーム(nutrition support team:NST)や在宅療養サポートチーム(home care support team:hST)〕で考えていくことが重要である.
また,このような終末期における栄養療法を考えるにあたって心に留めておくべきことは,食支援が終末期に入ってから行うものではないということである.つまり,余命1カ月からの摂食嚥下支援ではなく,人生の最終段階を迎える前からの食支援が求められている.
■在宅療養における栄養管理の問題点(文献12-1-1)
人生の最終段階に至っていない栄養療法が必要な高齢者のフレイル(frailty;虚弱)に対しても,栄養療法が打ち切られたり,誤った栄養経路を選択され複数年経過していたりするケースなど,病院NSTが介入していないのではないかと感じるケースが増えていると思われる.
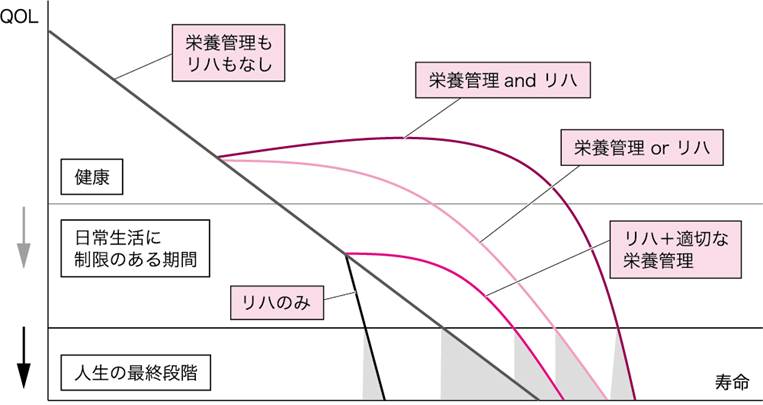
図Ⅰ●栄養管理とリハで健康寿命の延伸と日常生活に制限のある期間のQOL向上
(文献12-1-1より引用)
病院NSTとして入院患者の栄養充足をめざす栄養療法を行うのであれば,まずは主観的包括的評価(subjective global assessment:SGA)アプローチにはじまり,客観的栄養評価(objective
data assessment:ODA)を行う.栄養障害が疑われる場合には,米国静脈経腸栄養学会(ASPEN)ガイドラインの栄養療法と栄養経路(第6章-1,p.162参照)に沿って,AHNを開始するということになる. 本来はAHNの導入を病院NSTが自信をもって提案し,栄養管理とリハビリテーション(以下,リハ)の両輪で回復にまでもっていくのがあるべき姿であり,退院後は hSTに引き継ぎ,平安な在宅療養を行うことが望ましい.
老化とともに摂食嚥下機能が低下し,QOLも低下していく.人生の最終段階に至る前から栄養管理とリハを行うことで,平均寿命と健康寿命が延伸する(図Ⅰ右から3番目).より早くから栄養管理とリハが行われることで,人生の最終段階を含むすべての時期で,QOLが向上するものと考える(図Ⅰ最右).近年,胃瘻を含めたAHNは延命治療と位置付けられてしまい,本来AHNが必要な患者に対して,栄養介入できないままに,遅い段階からの過度なリハのみを行い,より一層サルコペニアを悪化させているケースがみられている(図Ⅰ最左).
また,AHNを望まない人で,病院では状態が悪かった人も自宅に帰って状態が落ち着くと,hSTの支援によって自然と経口摂取が開始できることも多い. AHNが栄養状態を改善することだけを目標とするのではなく,あるときは,緩和治療として必要栄養と水分を充足しリハのサポートを行い,日常生活動作(ADL)を向上させ,またあるときは,緩和ケアとして日常生活に制限のある期間(平均寿命-健康寿命)のQOLも向上できると考えられる.
患者の望む目標をサポートするための適切な栄養管理を行うことは,人生の最終段階において平安な生活を過ごすことにつながるものと考えられている.人生の最終段階にはさまざまな身体の徴候がみられ,これに対する緩和的な栄養管理を推進することもhSTの大きな役割となる.
■病診連携ツール(連携パス,連携シート)(参考文献12-1-2)
在宅療養およびそれを支える在宅医療では医療職だけでなく介護福祉職も含めた多職種連携が重要である.ここでは大津市を例に連携に役立つツールを紹介する.
大津市では,後方連携としての数々の病診連携パスが運用されている.そのなかで,胃瘻患者における栄養管理も含めた業務内容や手順を把握することを目的として,2008年12月にPEG地域連携パス(以下,PEGパス)を作成した.当初はこのパスに看護師や薬剤師,ケアマネジャーなど在宅療養に携わる医療介護福祉職の業務を記載できるようにと考えていたが,PEGパス自体が医療者用で,治療(医療)を前提にしたツールであったため,各種医療行為の実施状況のチェックや,検査予定を管理する資料の域を出ず,在宅患者に総合的なケア(療養)を提供するうえでは不十分であった.
そもそも在宅療養では,自宅での生活を重視すると同時に,患者が望む最終的な目標に対してどのようなケアをサポートできるかが重要である.「自分で食事をとれるようになりたい」という胃瘻患者に対しては,胃瘻管理と栄養管理だけではなく,患者の病態や生活背景を踏まえたうえで,誤嚥性肺炎を起こさない食べ物や調理方法,食べ方の検討や対応が,医療介護福祉職それぞれに求められる.
このような条件を満たすツールとして作成されたのが在宅療養連携シート(以下,連携シート)である.連携シートは,病院医療が在宅療養へシフトしていくなかで,介護福祉職を加えた多職種連携を推進していくためのツールであり,介護福祉職の基本的な考え方となっている国際生活機能分類(International Classification of Functioning, Disability and Health:ICF)2001に重きを置き,在宅療養を支える医療職と介護福祉職が共有できるようになっている.ケアカンファレンスや退院時カンファレンス時に,ケアマネジャー(CM)かメディカルソーシャルワーカー(MSW)が作成する.在宅療養での情報が満載であり,訪問指導を行う医療職〔歯科医師,薬剤師,看護師,歯科衛生士,管理栄養士,セラピスト(理学療法士,言語聴覚士,作業療法士)など〕に,患者(利用者)の生活模様がわかる内容となっている.各種後方連携パスの使用状況も記載でき,病病・病診・診診ともリンクできるように配慮されている.また,人生の最終段階での人工栄養や,緩和治療などについての本人の思い,家族の思いも記載できるように工夫されている.連携シートは,多職種がかかわっているため,患者の医療情報(看護の情報),介護福祉の情報を1枚のシートにまとめたものであることから,医療職と介護福祉職の鎹になっていくと考えられている.
また,PEGパス小委員会にて,PEGパスとその使用マニュアルの改訂作業が行われた.PEGケア,口腔ケア,嚥下訓練,簡易懸濁法,栄養管理に加えて,半固形栄養剤の指導の欄をパスに追加し,いつから指導管理料を算定したか,重複していないかの確認ができる欄や,退院の際に病院が指導管理料を開始し,しっかりと経口摂取に向けての指導もすることを明記した文言が含まれている.さらには,アルブミン測定方法についても加筆された.連携シート,PEGパスは大津市医師会のホームページに掲載されているため,参照されたい(http://www.otsu.shiga.med.or.jp/organ)(参考文献12-1-3).
関連キーワード
· [1] 栄養サポートチーム(NST)・在宅療養サポートチーム(hST)[nutrition support team, home care support team]
訪問栄養食事指導の実際
■概論
療養者が在宅で安心して生活が続けられるよう,食事や栄養面での支援を行うサービスとして訪問栄養食事指導がある.管理栄養士は療養者の自宅を訪問し,食事状況を確認したうえで適切な食事内容を提案する.家族には調理方法などを具体的に伝え,在宅で安心して生活し続けられるようサポートする.
しかし,訪問栄養食事指導というシステムや,在宅訪問管理栄養士の知名度はまだまだ低く,地域の資源として十分活用されていないのが実情である.本節では,訪問栄養食事指導とはどのようなシステムなのか,在宅での栄養ケア・マネジメントが病院で行われるものとはどう異なるのか,などをまとめた.さらに地域包括ケアシステムにおける管理栄養士の役割や栄養ケア・ステーションについて触れ,社会的資源として何が必要とされているかを述べる.このような栄養の支援を地域の資源として広くとらえることは,最期まで食べ続けることができる地域づくりにつながると考えられる.
後半では,最期まで自宅で過ごしたい・過ごさせたいと希望する患者・家族を支えるための取り組みを紹介する.岐阜県の総合在宅医療クリニックでは食楽支援と称し,栄養という側面だけではなく多方面から食の支援を行っている.食べる力の評価を行い,食べられる口づくりと口腔機能向上へのモチベーションアップにつなげる.食の意思決定支援では,具体的なイメージができず揺れ動く患者・家族の思いに沿い,伴走者としてともに考えながら最善の方法を見つけて進んでいくことを支える.看取りの食支援は終末期の限られた時間をいかによい時間にできるかを考え,最期までできることを家族とともに実践していく.さらに家族のグリーフケアにもつながる支援を提案する.
関連キーワード
· [1] 訪問栄養食事指導[home visit for nutritional and dietary advice]
· [2] 在宅での栄養ケア・マネジメント[nutrition care and management at home]
· [4] 栄養ケア・ステーション[nutrition care station]
· [5] 食支援(“食楽支援”)[syokurakushien]
· [6] 食べる力の評価[evaluation of eating competence]
· [7] 食の意思決定支援[advance care planning in eating]
· [8] 看取りの食支援[nutrition support at the end of life]
在宅での経腸栄養法・静脈栄養法
■在宅における栄養投与経路
はじめに,在宅における栄養投与経路の状況について,滋賀県を例に解説する.滋賀県では,推進施設を中心にサテライト施設(長期療養型施設・診療所・訪問看護ステーション・グループホームなど)との関連を密とし,胃瘻患者管理の質的向上(食べるためのPEG含め)を図り,一括管理することで緊急時に対応可能な組織づくりを目標として,滋賀PEGケアネットワークが2004年に発足された.このネットワークでは,2011年と2017年に,在宅と老人福祉施設での栄養投与経路についてのアンケート調査を行った(図Ⅰ).2011年から2017年で経口摂取が減り,2011年に9.52%であった人工的水分・栄養補給法(artificial hydration and nutrition:AHN)が2017年は11.33%に増加していた.しかし,胃瘻は7.80%から6.46%に減った.つまり,AHNが増えているのにもかかわらず胃瘻が減っていた.その分,経鼻胃管が増え,若干静脈栄養も増えた.このように本来は胃瘻にするべき人が経鼻胃管になっていたり,腸が安全に使えるのに生理的ではない方法を選択されるという状況は,滋賀県に限らず起こっていると考えられる.

図Ⅰ●2011年・2017年の栄養投与経路の比較
また,大津市の訪問看護ステーションにおいても,4年前から年に1回,栄養投与経路についてのアンケートを行っている.2018年は,前年まで増えてきていた胃瘻が減少に転じ,経鼻胃管が著増していた.2018年に経管栄養患者(113人)を対象に何らかの抑制の有無について質問したところ,抑制がある患者は20.4%となっていた.内訳を見ると経鼻胃管患者において83.3%に抑制がみられ,胃瘻患者において抑制がある人は2.3%であった.
また,経口摂取を併用することも非常に重要であり,経口併用の患者も少しずつ増えてきている.経口併用の経管栄養ルートでは胃瘻が大半を占めており,腸瘻の患者が1人,経鼻胃管の患者は1人もいなかった.つまり胃瘻患者の方が高いQOLを維持したまま在宅で過ごせていることが示される結果であった.
経腸栄養剤の形態は,ラコール®NF配合経腸用半固形剤が上市されたこともあり,2015年,2016年,2017年と少しずつ半固形が増えてきていたが,2018年は経鼻胃管が増えたことで減少に転じている.
■ 摂食嚥下機能のレベルと栄養投与ルートの選択(参考文献12-3-1)
摂食嚥下機能のどのレベルでどの栄養投与ルートを選択し,開始・減量するかは明確にされていない.患者ごとにオーダーメイドでというと聞こえはよいが,現状は,医療者の都合や家族の都合になってしまっているのではないかと懸念される.
栄養投与ルートを決定するうえで重要となる具体的な指標は唾液誤嚥の有無である.本来,誤嚥しやすい形態は,食物(固形)よりも唾液(0.5%とろみ水)のような水分であり,食物誤嚥が重症化して唾液誤嚥になるのではない.唾液誤嚥が生じることは患者の意識レベルが低下し,嚥下反射レベルが低下することを意味していると考える.意識レベルが低下しているなかで経管栄養を行うことは,唾液量の増加につながり,誤嚥性肺炎をきたすことにもつながる可能性がある.
超高齢者,認知症患者,人生の最終段階を迎えようとしている患者にAHNを導入するべきかどうかといった倫理的な問題は,栄養療法を行ううえで避けて通ることができない重要な課題である.栄養(食)は人間にとって命の源である.キュアよりもケアを重視する在宅療養では,患者の望む目標をサポートするためのAHNであることが重要である.「生きている(命)ためのAHNではなく,生きていく(生活)ためのAHN」であれば,患者のQOLを向上させることにもつながり,人生の最終段階においても平安な生活を過ごすことにつながる.
重要なことは,人生の最終段階ではない患者にAHNを導入しないことで人生の最終段階に誘導してしまったり,人生の最終段階の最重度の唾液誤嚥の患者にAHNを導入してQOLの低い人生を過ごさせてしまうことのないようにすることである.例えば唾液誤嚥の状態において積極的なAHNをすることを望むのであれば,AHNよりも先に,嚥下機能改善手術や気管食道分離術を考慮することも選択肢となる.
■ 在宅栄養療法とそれにかかわる診療報酬
経口摂取では必要量の栄養を摂取することができない患者が,家庭・社会復帰を実現する方法として在宅栄養療法がある.これにより入院患者を減らし,在院日数を短縮するという病院側のメリットはあるが,あくまで患者や家族自身が希望したうえでの家庭・社会復帰である.
在宅栄養療法には在宅経腸栄養法(home enteral
nutrition:HEN)と在宅静脈栄養法(home parenteral
nutrition:HPN)があり,HENは1988年より医療保険適用が開始された.当初は適応疾患が限られ,都道府県知事への届出が必要であったが,1992年に在宅成分栄養経管栄養法と名称変更され,1994年からは適応疾患の制約が撤廃されて届出も必要なくなった.しかし,この在宅成分栄養経管栄養法指導管理料を算定できる栄養剤はツインライン®NF,エレンタール®,エレンタール®Pの3種類の経腸栄養剤のみで,他の経腸栄養剤を使用する場合は,在宅寝たきり患者処置指導管理料などとして算定される.したがって,在宅経管栄養法に対しての指導管理料や材料費などは算定できないのが現状である.これにより,十分な管理ができていないケースや,医療材料の提供が滞ってしまうことが危惧されていた.そのようななか,2018年度の改定にて在宅半固形栄養経管栄養法指導管理料が新設され,期待が寄せられている.
HPNは1985年に主として小腸機能不全患者に対して保険適用となった.その後,1992年に悪性疾患が適応に含まれ,1994年には疾患を問わず医師が必要と認めたものなら保険適用となった.これにより,末期がん患者を在宅に移行できるようになり,HPN症例が増加している.HPNでは,在宅中心静脈栄養法指導管理料の他,材料費算定やポンプ加算などが可能である.管理者は医療材料を十分に提供し,カテーテルに関連した感染を最小限に留めるようにすることが重要である.HENにおいてもHPNにおいても目標をもって導入し,看護師,薬剤師,栄養士,セラピストと協働してサポートしていくことが必要である.
また,療養病棟入院基本料は,医療区分と日常生活動作(ADL)区分によって設定されている.胃瘻患者は,従来であれば医療区分1,発熱または嘔吐を伴う胃瘻患者や,喀痰吸引が1日8回以上の場合のみ,医療区分2となる.一方,静脈栄養における,24時間末梢持続点滴と中心静脈栄養(total parenteral
nutrition:TPN)は医療区分3である.いずれも,医師・看護師の行う医療行為であるが,区分が異なる.
表Ⅰに,在宅での栄養療法にまつわる診療報酬を列挙する.

(参考文献12-3-2,12-3-3をもとに作成)
関連キーワード
· [1] 人工的水分・栄養補給法(AHN)[artificial hydration and nutrition]
· [3] 在宅経腸栄養法(HEN)[home enteral nutrition]
· [4] 在宅静脈栄養法(HPN)[home parenteral nutrition]
キーワードでわかる臨床栄養 令和版
頁 場所 修正前 修正後 補足 掲載
第10章10 脳卒中
310 右段「6 GFO療法」
6〜8行目
現在,GFO®が発売されているが,乳糖
が少量含まれており,乳糖不耐症には
使用できない.
現在,GFO®が発売されている。以前は
乳糖が少量含まれており乳糖不耐症に
は使用できなかったが、2021年以降の
製品ではフラクトオリゴ糖に変更されて
いる。
23/12/29
頁 場所 修正前 修正後 補足 掲載
第5章1 栄養スクリーニング・アセスメント
140 表2 GNRI=[14.89×血清アルブミン
(g/dL)]+[47.1×(現体重kg/理想体重
kg)]
GNRI=[14.89×血清アルブミン
(g/dL)]+[41.7×(現体重kg/理想体重
kg)]
21/10/29
第10章10 脳卒中
310 右段「6 GFO療法」
6〜8行目
現在,GFO®が発売されているが,乳糖
が少量含まれており,乳糖不耐症には
使用できない.
現在,GFO®が発売されている。以前は
乳糖が少量含まれており乳糖不耐症に
は使用できなかったが、2021年以降の
製品ではフラクトオリゴ糖に変更されて
いる。
23/12/29
第12章2 訪問栄養食事指導の実際
388 表1 ・・・脂質異常症食,痛風食,てんかん
食,心臓疾患・・・
・・・脂質異常症食,痛風食,心臓疾
患・・・
「てんかん食」削除 20/05/29
388 表1 フェニルケトン尿症食,メープルシロップ
尿症食,ホモシスチン尿症食・・・
てんかん食,フェニルケトン尿症食,メー
プルシロップ尿症食,ホモシスチン尿症
食・・・
「てんかん食」追加
20/05/29
